Acetylsalicylzuur
Acetylsalicylzuur is een medicijn dat pijnstillend, koortsverlagend en ontstekingsremmend werkt. Het middel was onder de merknaam Aspirine, of merkloos als acetylsalicylzuur (ook wel acetosal) voor de opkomst van paracetamol de meest gebruikte pijnstiller. Acetylsalicylzuur wordt tegenwoordig in lage dosering zeer veel voorgeschreven ter voorkoming van beroerten en hartinfarcten.[1]
| Neem het voorbehoud bij medische informatie in acht. Raadpleeg bij gezondheidsklachten een arts. |
Acetylsalicylzuur
| ||||
| Chemische structuur | ||||
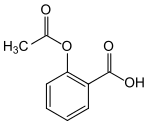 | ||||
Structuurformule van acetylsalicylzuur | ||||
 | ||||
Molecuulmodel van acetylsalicylzuur | ||||
| Farmaceutische gegevens | ||||
| Beschikbaarheid (F) | 80–100% | |||
| Metabolisatie | Hepatisch | |||
| Halfwaardetijd (t1/2) | 300-650mg: 3,1u 1g: 5u, 2g: 9u | |||
| Uitscheiding | Renaal | |||
| Gebruik | ||||
| Geneesmiddelengroep | Analgetica | |||
| Subklasse | Salicylaten | |||
| Merknamen | Bayer asperine, vele anderen | |||
| Indicaties | Pijn, koorts, ontsteking, cardiovasculaire preventie | |||
| Toediening | Oraal | |||
| Risico met betrekking tot | ||||
| Zwangerschapscat. | C | |||
| Databanken | ||||
| CAS-nummer | 50-78-2 | |||
| ATC-code | A01AD05 | |||
| PubChem | 2244 | |||
| DrugBank | APRD00264 | |||
| Farmacotherapeutisch Kompas | acetylsalicylzuur | |||
| Chemische gegevens | ||||
| Molecuulformule | C9H8O4 C6H4(OCOCH3)COOH | |||
| IUPAC-naam | 2-(acetyloxy)benzeencarbonzuur | |||
| Molmassa | 180,157 g/mol | |||
| Smeltpunt | 136°C | |||
| Kleur | Wit | |||
| Oplosbaarheid | (bij 20 °C) 3,0 g/L | |||
| Dichtheid | 1,40 g/cm³ | |||
| Aggregatietoestand | Vast | |||
| ||||
Aspirine lijkt het risico op bepaalde soorten kanker te verminderen, met name darmkanker.[2] Wanneer het ingezet wordt als pijnstiller of koortsverlager, beginnen de effecten meestal binnen 30 minuten. Aspirine wordt geclassificeerd als een niet-steroïde ontstekingsremmer (NSAID).[1]
Aspirine is een van de meest gebruikte medicijnen ter wereld, met een geschat verbruik van ongeveer 40.000 ton (50 tot 120 miljard pillen) per jaar.[3] De stof is opgenomen in de lijst van essentiële geneesmiddelen van de WHO, waarin de meest effectieve en veilige medicijnen staan vermeld die nodig zijn in de gezondheidszorg.
Geschiedenis van acetylsalicylzuur
Van wilgenblad tot acetylsalicylzuur
Reeds omstreeks 2000 voor Christus gebruikten de Assyriërs wilgenbladeren voor de behandeling van pijnlijke gewrichten. Geschriften van rond 1550 voor Christus tonen aan dat ook de oude Egyptenaren een brouwsel van wilgenbladeren gebruikten tegen pijn en ontstekingen. Hippocrates propageerde eveneens het gebruik van wilgenbastextract. Dit extract heeft echter geen pijnstillend effect, smaakt bijzonder bitter en ligt slecht op de maag. De werkzame stof in het extract is salicine. Een stof die verwant is aan salicine treft men onder andere ook aan in moerasspirea. Salicine, of salicylzuur werkt koortsverlagend, maar heeft geen pijnstillend effect. Het pijnstillende effect van acetylsalicylzuur is volledig gebaseerd op de acetylgroep, die synthetisch wordt toegevoegd. Het koortsverlagende effect van het salicylzuur liet mensen zich beter voelen, maar was niet pijnstillend.
In 1763 beschreef de Engelse predikant Edmund Stone de pijnstillende en koortsverlagende werking van extracten van de wilgenbast. In 1825 probeerde Francesco Fontana in Italië het extract te zuiveren, evenals Johann Andreas Buchner die hetzelfde in 1828 probeerde. Het was echter de Fransman Henri Leroux die in 1829 als eerste de werkzame stof salicine, uit het extract in zuivere vorm isoleerde.
De Italiaanse onderzoeker Raffaele Piria ontdekte in 1838 dat salicine een glycoside, een soort suikerverbinding, was. Hij wist het suikerachtige gedeelte van het salicine af te splitsen en verkreeg op die manier voor het eerst salicylzuur. In 1859 wist de Duitser Kolbe de chemische structuur van salicylzuur te achterhalen en het zelf ook te synthetiseren. In de daaropvolgende jaren werd gewerkt aan het op industriële schaal produceren van salicylzuur.
In 1874 lukte dat voor slechts een tiende van de prijs van het wilgenextract. Strikt (chemisch) genomen was dit commerciële product geen salicylzuur maar natriumsalicylaat.[4] Al snel werd duidelijk dat het bitter smakende middel schadelijk was voor de maag.[5]
Teneinde de nadelige eigenschappen van salicylzuur te verminderen, ging men op zoek naar chemische varianten van salicylzuur. Salicylzuur bestaat uit een fenolgroep, ofwel een benzeenring met een hydroxylgroep, en een carboxylgroep. De carboxylgroep was eerder al eens vervangen door een amide. Een alternatieve methode is om iets aan de fenolgroep te veranderen. Charles Frédéric Gerhardt acetyleerde in 1853 de fenolgroep en verkreeg zo voor het eerst acetylsalicylzuur. De stof was onzuiver en instabiel; in die tijd had men er geen interesse in.[4]
Aspirine
Gerhardts uitvinding werd herontdekt en doorontwikkeld tot een toepasbaar medicijn in de vorm van acetylsalicylzuur in het laboratorium van de Duitse farmaceutische fabrikant Bayer te Elberfeld. De merknaam Aspirine, oorspronkelijk in het Duits Aspirin, is afgeleid van Spirsäure. Dit is een oude Duitse naam voor salicylzuur met het voorvoegsel A dat voor acetyl staat omdat het geacetyleerd salicylzuur betrof. Samengevoegd en verkort werd dit "Aspirin".[5] Over de wijze waarop acetylsalicylzuur bij Bayer is ontwikkeld, bestaan twee lezingen. Was het door Felix Hoffmann of Arthur Eichengrün? Geconcludeerd mag worden dat de rol van beide heren onontbeerlijk was.
Lange tijd werd de ontdekking van acetylsalicylzuur algemeen toegeschreven aan Felix Hoffmann, een medewerker van Bayer, die na zijn diensturen een pijnstillend middel gezocht zou hebben voor zijn zwaar reumatische vader. Door systematisch te werk te gaan zou hij hebben gezocht naar een nieuwe verbinding om het middel beter verteerbaar te maken. In 1897 zou hij de oplossing van het probleem hebben herontdekt in de acetylering van het salicylzuur. Op 10 augustus 1897 zou hij in zijn laboratoriumdagboek hebben beschreven hoe hij het acetylsalicylzuur in chemisch zuivere en bewaarbare vorm had samengesteld. In samenwerking met de arts Heinrich Dreser zou hij de nieuwe stof uitgebreid hebben getest op dieren. In 1899 kwam het middel in poedervorm op de markt. Een jaar later waren er de gedoseerde tabletten.
Uit onderzoek van de labjournaals bij Bayer blijkt echter dat de werkelijke ontdekker van acetylsalicylzuur Arthur Eichengrün was, die onderzoek deed naar betere pijnstillers. Felix Hoffmann werkte als laboratorium-assistent onder diens leiding. Vanwege Eichengrüns joodse achtergrond werd hij door de nazi’s uit de annalen geschrapt en werd het verhaal van de reumatische vader bedacht. In 1949 publiceerde Eichengrün een artikel waarin hij de uitvinding van acetylsalicylzuur claimde. Deze claim werd bevestigd na onderzoek van Walter Sneader van de universiteit van Glasgow in 1999.[6] De vraag wie de werkelijke ontdekker van acetylsalicylzuur is, bleef echter controversieel. Bayer weersprak in een persbericht de bevindingen van Sneader.
Aspro
Een apotheker uit het Australische Melbourne, George Nicholas, probeerde in 1914 acetylsalicylzuur te maken. Hij kon dit doen omdat het patent op acetylsalicylzuur niet in Australië gold. De eerste pogingen waren onsuccesvol, omdat zijn product onzuiver was. Met de hulp van H.W. Smith lukte het in 1915 om hun acetylsalicylzuur te zuiveren, zodat het voldeed aan de eisen van de Britse Farmacopee. Aanvankelijk als Nicholas Aspirin op de markt gebracht, werd de naam al snel veranderd in Aspro. Het middel werd een succes.
Werking
Pijnstilling, koortsverlaging en ontstekingsremming
De pijnstillende (analgetische), koortsverlagende (anti-pyretische) en ontstekingsremmende (anti-inflammatoire) werking zijn gebaseerd op de remming van het enzym cyclo-oxygenase.
Pijn wordt veroorzaakt door chemische stoffen die vrijkomen na beschadiging van weefsels en cellen. Zowel de beschadigde cellen als onbeschadigde cellen in de onmiddellijke nabijheid van de weefselschade geven, onder invloed van onder andere cytokinen en mitogenen, dergelijke stoffen af, zoals bradykinine, histamine, kalium- en waterstofionen. Deze stoffen werken op zenuwuiteinden in, die daardoor elektrische signalen naar de hersenen sturen die vervolgens als pijn worden geïnterpreteerd.
Autacoïden die in dit proces een belangrijke rol spelen zijn prostaglandinen. Prostaglandinen veroorzaken zelf geen pijn, maar verergeren de door de andere chemische stoffen veroorzaakte pijn. Daarnaast spelen ze een zeer belangrijke rol bij vele fysiologische processen in het lichaam. Prostaglandine wordt geproduceerd in cellen en werkt alleen in de buurt waar het geproduceerd is en wordt dan afgebroken. Het stimuleert, naast verergeren van de pijnreactie, ook het optreden van ontstekingsreacties en zorgt voor het ontstaan van koorts.
In lichaamscellen speelt het enzym cyclo-oxygenase (COX) een essentiële rol in het maken van prostaglandine. Cyclo-oxygenase katalyseert de omzetting van arachidonzuur naar prostaglandine. Acetylsalicylzuur remt de werking van cyclo-oxygenase waardoor er minder of geen prostaglandine meer ontstaat. Daardoor verdwijnt een groot gedeelte van de pijn, zakt de koorts en worden ontstekingsreacties geremd. Acetylsalicylzuur is dus een inhibitor: een stof die de activiteit van een eiwit remt of stopt, in dit geval die van COX.
Daarnaast spelen prostaglandinen ook nog een rol in bij de normale celfunctie. De prostaglandine die door COX-1 ontstaat werkt in de normale celprocessen als boodschapper. De prostaglandine die werkt bij beschadiging en die een rol speelt in het pijnsignaal, wordt gemaakt door COX-2. COX-1 kan als het niet functioneert maagbloedingen veroorzaken, doordat prostaglandinen een beschermende werking op de maagwand hebben. Er is sinds een aantal jaren een aantal andere geneesmiddelen op de markt die selectieve COX-2-remmers zijn.
Hoewel acetylsalicylzuur nog steeds populair is geven medici tegenwoordig de voorkeur aan het voorschrijven van paracetamol wanneer een eenvoudige pijnstiller geïndiceerd is.
Andere werkingen
Effect op de bloedplaatjes
Acetylsalicylzuur is niet alleen een analgeticum of pijnstillend middel, maar heeft tevens een onomkeerbaar effect op de bloedplaatjes. Het belemmert deze om samen te klonteren en is daarmee een trombocytenaggregatieremmer. Hierdoor vermindert het stelpend vermogen van het bloed bij bloedvatbeschadiging. Het effect treedt al op na 1/4 acetylsalicylzuurtablet van 500 mg en houdt aan tot de uitgeschakelde bloedplaatjes (na ongeveer een week) allemaal zijn vervangen. Voor dit laatste effect wordt het middel tegenwoordig in een lage dosis zeer veel voorgeschreven aan mensen die eerder een beroerte (dosis van 30–80 mg) of hartinfarct (dosis van 80 mg) hebben gehad; het vermindert de kans op herhaling met circa 40%.
Voorheen werd 30 mg veel gekozen door neurologen, omdat dit voldoende bescherming gaf voor neurologische klachten. De laatste jaren is men echter nagenoeg volledig in de neurologie opgeschoven naar de 80 mg dosis die in de cardiologie gebruikelijk is, omdat daarmee ook een beschermend effect op het hart is naast de reductie van het cerebrovasculaire risico. Omdat in de neurologie eigenlijk een combinatie van dipyridamol + acetylsalicylzuur + (vaak) een maagbeschermer nodig was voor optimale preventie en omdat het Nederlandse beleid afweek van het Europese beleid, kiest de arts bij een CVA of TIA steeds vaker voor het opstarten van de trombocytenaggregatieremmer clopidogrel in plaats van de eerder genoemde combinatie van 3 middelen.
Vaak wordt ook het calciumzout van acetylsalicylzuur voorgeschreven, carbasalaatcalcium, omdat men oorspronkelijk dacht dat carbasalaatcalcium wat minder bezwaarlijk voor de maagwand zou zijn dan acetylsalicylzuur. Uit onderzoek is inmiddels gebleken dat maagbloedingen net zo vaak voorkomen bij carbasalaatcalcium als bij acetylsalicylzuur[7][8]. Carbasalaatcalcium moet in het lichaam gesplitst worden in calcium en in acetylsalicylzuur voordat het werkzaam is. Hierdoor komt 100 mg carbasalaatcalcium overeen met 80 mg acetylsalicylzuur.
In 2008 zagen de registratieautoriteiten zich genoodzaakt te waarschuwen voor de interactie tussen ibuprofen en laag gedoseerd acetylsalicylzuur. Ibuprofen heeft als enige NSAID een unieke wisselwerking met laaggedoseerd acetylsalicylzuur. Ibuprofen verhindert de beschermende werking van acetylsalicylzuur op hart en bloedvaten.[9]
Andere toepassingen
Op het gebied van de kankerpreventie liggen er mogelijk toepassingen voor acetylsalicylzuur, aangezien deze tumorvorming tegengaat. Het is echter twijfelachtig of het dagelijks innemen van een lage dosis acetylsalicylzuur gedurende ten minste vijf jaar de kans op tumoren in slokdarm en darmstelsel zou doen afnemen.[10][11] Uit onderzoek blijkt dat het dagelijks gebruik van een lage dosis acetylsalicylzuur een positief effect heeft op de levensduur van patiënten met kanker in het spijsverteringskanaal.[12]
Naar het schijnt heeft acetylsalicylzuur ook een positieve werking tegen zwangerschaps-, darm-, hart- en vaatziekten. Het eerder beweerde positieve effect van acetylsalicylzuur op de ziekte van Alzheimer kon na onderzoek niet gevonden worden.[13]
Een combinatie van acetylsalicylzuur en Metoclopramide onder de merknaam Migrafin wordt gebruikt bij de behandeling van migraine.
Bijwerkingen
Acetylsalicylzuur is vrij sterk maagprikkelend. Bij gebruik kunnen maagklachten en zelfs maagbloedingen ontstaan. Acetylsalicylzuur heeft vooral in hoge doseringen ernstige bijwerkingen. Naast de al genoemde maagbloedingen kunnen ook oorsuizen en doofheid optreden.
Gebruik bij zwangerschap, borstvoeding[14] en toediening aan baby's en zeer jonge kinderen (syndroom van Reye) wordt afgeraden. Bij kinderen tot 16 jaar heeft de keuze voor een andere analgeticum (pijnstiller) dan acetylsalicylzuur de voorkeur, bijvoorbeeld paracetamol.
Maximaal 5-21% van de astma-patiënten heeft een acetylsalicylzuurovergevoeligheid.[15] Inname kan dan leiden tot rode plekken op de huid en jeuken, loopneus en natte ogen, en in meer zeldzame gevallen een astma-aanval. Astmapatiënten die weten dat ze overgevoelig zijn voor acetylsalicylzuur zullen geen acetylsalicylzuur, of cyclo-oxygenase-remmers gebruiken.
Mensen en vooral ouderen die dagelijks acetylsalicylzuur innemen lopen twee keer meer kans op de oogaandoening maculadegeneratie. Het leidt op den duur tot slechtziendheid.[16][17]
Synthese van acetylsalicylzuur
Bij het maken van acetylsalicylzuur op laboratoriumschaal gaat het om een opbrengst van enkele grammen. Bij de bereiding van acetylsalicylzuur kan worden uitgegaan van verschillende beginproducten. In deze beschrijving wordt uitgegaan van salicylzuur. Dit heeft als voordeel dat er maar een synthesestap uitgevoerd hoeft te worden. Uitgaande van salicylzuur en azijnzuuranhydride, wordt salicylzuur veresterd volgens onderstaande reactie:
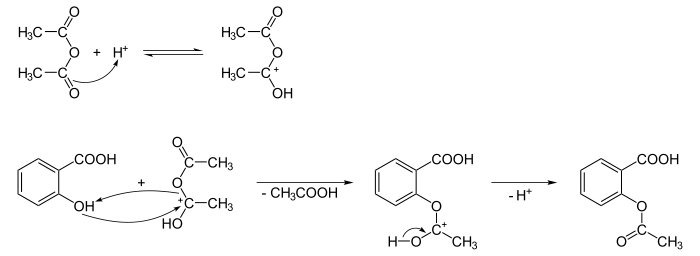
Zoals te zien boven de reactiepijl vindt deze synthese plaats in een zuur milieu. Na de reactie moet het hoofdproduct (acetylsalicylzuur) gescheiden worden van de bijproducten (azijnzuur en niet verbruikte reactanten); dit gebeurt door middel van herkristallisatie.
De herkristallisatie wordt uitgevoerd door het ruwe product op te lossen in methanol of ethanol en aan de kook te brengen in een refluxopstelling. Vervolgens wordt dan net genoeg water toegevoegd zodat de verontreinigingen uitkristalliseren, maar de acetylsalicylzuur niet. Het mengsel van ongeveer 78 °C, het kookpunt van ethanol, wordt nu gefiltreerd, waardoor de verontreinigingen op het filter achterblijven en alleen het zuivere acetylsalicylzuur in het filtraat komt. Na deze filtratie wordt het filtraat gekoeld en eventueel opnieuw gefiltreerd, het gezuiverde acetylsalicylzuur blijft nu achter op het filter. Het verkregen acetylsalicylzuur kan nu worden gedroogd in bijvoorbeeld een droogstoof. In het lab is het met deze syntheseroute mogelijk om een opbrengst van 90% en een zuiverheid van 99% te verkrijgen.
Externe links


- (en) Gegevens van Acetylsalicylzuur in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
Bronnen, noten en/of referenties
|
| Carbonzuren | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| Zie de categorie Acetylsalicylic acid van Wikimedia Commons voor mediabestanden over dit onderwerp. |