Fenol
Fenol of hydroxybenzeen, vroeger ook wel carbolzuur of carbol genoemd, is een organische verbinding bestaande uit een benzeenring waarvan één waterstofatoom is gesubstitueerd door een hydroxylgroep (OH). Fenol is daarom een aromatische alcohol. In oudere teksten wordt fenol soms benzol genoemd, al is dit een germanisme: Benzol is de Duitse benaming voor benzeen.
Fenol
| |||||
| Structuurformule en molecuulmodel | |||||
 | |||||
Structuurformule van fenol | |||||
 | |||||
Fenolkristallen | |||||
| Algemeen | |||||
| Molecuulformule (uitleg) | C6H5OH | ||||
| IUPAC-naam | fenol | ||||
| Andere namen | fenylalcohol, benzenol, hydroxybenzeen | ||||
| Molmassa | 94,11 g/mol | ||||
| SMILES | C1=CC=C(C=C1)O | ||||
| InChI | 1/C6H6O/c7-6-4-2-1-3-5-6/h1-5,7H | ||||
| CAS-nummer | 108-95-2 | ||||
| EG-nummer | 203-632-7 | ||||
| PubChem | 996 | ||||
| Beschrijving | Kleurloze naaldvormige kristallen met een kenmerkende geur[1] | ||||
| Vergelijkbaar met | benzeen | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H301 - H311 - H314 - H331 - H341 - H373 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P261 - P280 - P301+P310 - P305+P351+P338 - P310 | ||||
| Omgang | Damp niet inademen, blootstelling vermijden en gebruik onder inerte gasatmosfeer | ||||
| Opslag | Verwijderd houden van hitte, vonken en open vlammen; bewaren bij 2-8 °C onder inerte gasatmosfeer | ||||
| EG-Index-nummer | 604-001-00-2 | ||||
| VN-nummer | 1671 | ||||
| ADR-klasse | Gevarenklasse 6.1 | ||||
| MAC-waarde | 19 mg/m³ | ||||
| LD50 (ratten) | (huid) 669 mg/kg (intraperitoneaal) 127 mg/kg (subcutaan) 460 mg/kg | ||||
| LD50 (konijnen) | (huid) 630 mg/kg | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | wit | ||||
| Dichtheid | 1,071[1] g/cm³ | ||||
| Smeltpunt | 41[1] °C | ||||
| Kookpunt | 182[1] °C | ||||
| Vlampunt | 82[1] °C | ||||
| Zelfontbrandings- temperatuur | 595[1] °C | ||||
| Dampdruk | 20[1] Pa | ||||
| Oplosbaarheid in water | 82[1] g/l | ||||
| Evenwichtsconstante(n) | pKa = 9,95 | ||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Fenol is de naamgever van de fenolen, een groep aromatische verbindingen die een of meer OH-groepen rechtstreeks op de benzeenring gesubstitueerd heeft staan. Voorbeeld van dergelijke verbindingen zijn cresol en xylenol. Bij kamertemperatuur is fenol een kristallijne, vluchtige vaste stof met een kenmerkende geur.
Fenol is een van de belangrijkste industriële chemicaliën; de wereldwijde productie in 2004 was ongeveer 7,7 miljoen ton.
Synthese
Fenol is een van de verbindingen die bij de fractionele destillatie van steenkoolteer ontstaan. Dit was de voornaamste bron van fenol voor de Eerste Wereldoorlog. Nadien werden specifieke synthesemethoden ontwikkeld, waarvan het cumeenproces commercieel het belangrijkst is.
Cumeenproces
De synthese van fenol op industriële schaal gebeurt in het cumeenproces, ook wel het Hock-proces genoemd. De grondstoffen zijn benzeen, propeen en zuurstofgas. Met benzeen en propeen wordt cumeen gevormd. Dat wordt met luchtzuurstof geoxideerd tot cumeenhydroperoxide, dat onder invloed van zwavelzuur in fenol en aceton wordt gesplitst. De netto-reactie is:
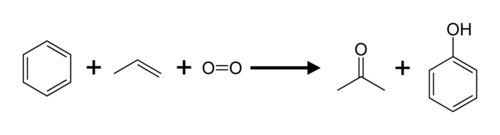
Meer dan 90% van alle fenol (en aceton) wordt via dit proces geproduceerd.
Raschig-Hooker-proces
Een ander, niet meer gebruikt, industrieel proces voor de productie van fenol is het Raschig-Hooker-proces.[2] Hierin wordt benzeen eerst met zoutzuur en zuurstofgas omgezet in chloorbenzeen (dit is een oxychlorering):
Als katalysator fungeert koper(II)chloride samen met aluminiumhydroxide. Het monochloorbenzeen wordt in een tweede stap op hoge temperatuur met stoom gehydrolyseerd tot fenol en zoutzuur:
De globale reactievergelijking is dus:
Het zoutzuur dat in de tweede stap ontstaat, wordt verbruikt tijdens de eerste stap, zodat een gesloten cyclus ontstaat. Nadelen van dit proces zijn het ontstaan van het erg corrosieve zoutzuur en de hoger gechloreerde bijproducten die bij de oxychlorering ontstaan. Het is daarom verdrongen door het cumeenproces.
Overige synthesemethoden
Naast beide processen die commericeel belangrijk zijn of waren, bestaan er nog andere mogelijkheden om fenol te bereiden. Een eerste methode is de omzetting van aniline in een aromatisch diazoniumzout met behulp van natriumnitriet en zoutzuur. Dit diazoniumzout wordt vervolgens met water behandeld, onder afsplitsing van stikstofgas en waterstofchloride:
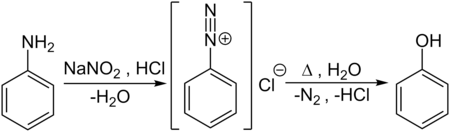 Synthese uit aniline
Synthese uit aniline
Een tweede mogelijkheid is de behandeling van benzeensulfonzuur met een hydroxide, zoals natriumhydroxide, bij verhoogde temperatuur:
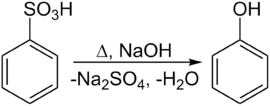 Synthese uit benzeensulfonzuur
Synthese uit benzeensulfonzuur
Door shikiminezuur in water te verwarmen tot dicht bij de kritische temperatuur (circa 350°C), wordt het gearomatiseerd, waarbij fenol als voornaamste reactieproduct wordt gevormd. Omdat shikiminezuur door Escherichia coli, een bacteriesoort, uit glucose wordt geproduceerd, zou dit een mogelijkheid bieden om fenol zonder het kankerverwekkende benzeen te maken.[3]
Eigenschappen en reacties
De hydroxylgroep in fenol kan associaties oproepen met die van de alcoholen. Op grond daarvan zou men geen echt zure eigenschappen verwachten van fenol. De Ka-waarde is echter zo groot dat zelfs titratie met natriumhydroxide in water mogelijk is. De negatieve lading van het anion dat ontstaat bij deprotonering van fenol, het fenolaat-anion, kan namelijk in de benzeenring worden gedelokaliseerd, zodat een zekere mate van stabilisatie optreedt. Als elektronenzuigende substituenten aanwezig zijn wordt de verbinding zelfs echt zuur, omdat de negatieve lading naar deze substituenten gelokaliseerd kan worden. Een voorbeeld is 2,4,6-trinitrofenol oftewel picrinezuur, dat met een pKa van 0,38 zo'n 24.000 keer sterker is dan azijnzuur.
Een ander gevolg van de relatief grote zuursterkte is dat, hoewel fenol niet echt in water oplost, de oplosbaarheid in een basisch milieu door de vorming van het fenolaat-anion wel opmerkelijk groter is. De fenolische OH-groep is een sterke ortho-pararichter waardoor elektrofiele aromatische substitutie op de parapositie betrekkelijk eenvoudig verloopt. Vooral substitutiereacties met elektrofielen zoals het nitrosyl- of het nitroniumkation verlopen altijd volledig.
Toepassingen
Fenol is een verbinding met zeer veel toepassingen in de organische synthese. Het is dan ook een grondstof voor zeer veel kunststoffen: fenolharsen zoals bakeliet en geneesmiddelen.
Fenol is onder meer een grondstof voor:
- bisfenol A
- caprolactam, dat op zijn beurt een grondstof is voor nylon
- alkylfenolen zoals nonylfenol, die worden gebruikt voor de synthese van stabilisatoren of antioxidanten in smeerolie en polymeren
- xylenolen, tussenproducten in de synthese van farmaceutische stoffen, antioxidanten en chemische bestrijdingsmiddelen
- cyclohexanol, waaruit adipinezuur gemaakt kan worden
- salicylzuur, dat een precursor is van acetylsalicylzuur (aspirine)
Toxicologie en veiligheid
Fenol is giftig bij opname door de mond, bij inhalatie en huidabsorptie. Tijdens de Tweede Wereldoorlog werden in diverse concentratiekampen duizenden gevangenen door middel van injecties met fenol vermoord. Er is echter ook een nuttige toepassing van fenol: men kan een storende spasme behandelen door een veel lagere dosis in water opgelost rond een zenuw te injecteren. Hierdoor raakt de zenuw verzwakt of wordt zelfs uitgeschakeld, waardoor de storende zenuwprikkels niet bij de spier aankomen. Dit proces heet fenoliseren van een zenuw. Fenol wordt ook gebruikt als conserveermiddel in vaccins.
Externe link
Bronnen, noten en/of referenties
|


