Nicotinamide-adenine-dinucleotide
Nicotinamide-adenine-dinucleotide (NAD) is een co-enzym dat in de cellen van alle levensvormen functioneert als biochemische elektronendrager. Het is een groot organisch molecuul dat met behulp van een enzym in levende wezens een bepaalde chemische reactie kan laten verlopen. NAD kan in twee vormen bestaan: als oxidator en als reductor. In de eerste toestand, die wordt aangeduid als NAD+, kan NAD elektronen opnemen. In de tweede vorm kan het elektronen afstaan; deze toestand wordt aangeduid als NADH.
Nicotinamide-adenine-dinucleotide
| ||||
| Structuurformule en molecuulmodel | ||||
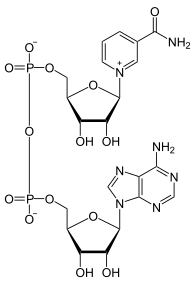 | ||||
▵ Structuurformule van geoxideerd NAD+ | ||||
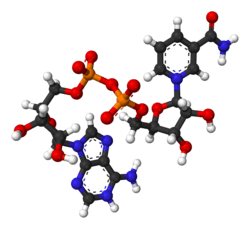 | ||||
▵ Molecuulmodel van geoxideerd NAD+ | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C21H27N7O14P2 | |||
| IUPAC-naam | Nicotinamide-adenine-dinucleotide | |||
| Andere namen | onder andere: [1]
| |||
| Molmassa | 663.43 g/mol | |||
| CAS-nummer | 53-84-9 | |||
| PubChem | 925 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| Hygroscopisch? | Ja | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Smeltpunt | 160 °C | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
NAD is van groot belang bij alle stofwisselingsprocessen. Op moleculair niveau is de stofwisseling van een organisme te beschouwen als een aaneenschakeling van redoxreacties: voortdurende omzettingen van chemische energie. NAD vervult in deze reacties een hoofdrol als elektronendrager. NAD+ neemt daarbij elektronen op uit voedingsstoffen zoals suikers en vetzuren. Het NADH dat zo ontstaat geeft vervolgens de elektronen af in diverse cellulaire processen die het organisme in leven houden.
NAD is niet alleen betrokken bij stofwisseling, maar ook bij DNA-reparatie, regulatie van genexpressie en signaaltransductie. In de meeste organismen wordt NAD de novo gevormd uit de aminozuren tryptofaan en asparaginezuur. Er bestaan ook syntheseroutes waarbij andere stoffen worden gebruikt, zoals het in voeding aanwezige nicotinezuur. Het op peil houden van de cellulaire NAD-concentraties is volgens huidige inzichten een bepalende factor in het tegengaan van veroudering.[2]
NAD wordt vaak in een adem genoemd met NADP, voluit nicotinamide-adenine-dinucleotidefosfaat. NADP wordt uit NAD gevormd door toevoeging van een fosfaatgroep aan een van de ribosen. De biologische functies van NADP zijn zeer vergelijkbaar met die van NAD. NADP wordt echter gebruikt als co-enzym bij fotosynthese en enkele assimilatiereacties, terwijl NAD voornamelijk een rol speelt bij celademhaling. NAD en NADP functioneren in meer dan 400 enzymatische reacties en zijn buitengewoon wijd verspreid in alle bekende levensvormen.[3]
Biochemie
Structuur en reactie
Nicotinamide-adenine-dinucleotide is, zoals alle dinucleotiden, opgebouwd uit twee nucleotiden die met elkaar verbonden zijn door een fosforbrug: een covalente binding tussen de twee fosfaatgroepen. Beide nucleotiden bevatten een ribose waaraan op de 1'-positie een nucleobase is gehecht. De ene nucleobase van NAD is een nicotinamide, de andere een adenine.[kleine-letter 1] Het nicotinamine kan in twee oriëntaties aan de 1'-positie gebonden zijn doordat het koolstofatoom een zogenaamde anomeer is. Dit maakt dat NAD+ in twee mogelijke diastereomeren (spiegelbeeldisomeren) kan voorkomen. Alleen de β-nicotinamide-diastereomeer van NAD+ is fysiologisch actief.
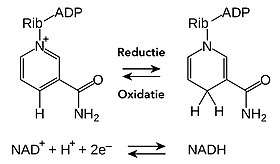
Tijdens stofwisselingsprocessen neemt NAD+ twee elektronen op en geeft deze door aan een ander molecuul.[6] De opname van twee elektronen gaat – zoals in veel redoxreacties – samen met de opname van twee waterstofionen (H+), zodat NADH wordt gevormd. In deze reactie, samengevat in onderstaande vergelijking, worden de twee waterstofionen aan de reactant onttrokken in de vorm van een hydride-ion (H–) en een proton (H+). Het proton komt vrij in de oplossing, het hydride-ion wordt overgedragen aan de nicotinamine-ring. De reactant RH2 wordt geoxideerd tot R en NAD wordt gereduceerd tot NADH.
De elektronen die in deze reactie worden uitgewisseld, worden overgedragen naar verschillende delen van de nicotinamine-ring. Een van de elektronen gaat naar het positief geladen stikstofatoom, het andere gaat naar het koolstofatoom op de 4’-positie (tegenover de stikstof), zodat daar een dubbele binding openbreekt. Het standaardelektrodepotentiaal van het NAD-redoxpaar is –0,320 volt,[7] wat het een sterk reducerend vermogen geeft.[kleine-letter 3] De reactie is eenvoudig omkeerbaar: NADH oxideert vlot tot NAD+. Dit betekent dat het co-enzym continu kan circuleren tussen de vormen NAD+ en NADH zonder dat het in een reactie wordt verbruikt.[8]
Fysische eigenschappen
Zoals veel co-enzymen is NAD een amorfe stof die in poedervorm voorkomt en over het algemeen een witachtig uiterlijk heeft. De stof is hygroscopisch en is zeer goed oplosbaar in water.[9] Vast NAD is stabiel wanneer het droog en donker wordt opgeslagen. Oplossingen van NAD in water zijn enkele dagen stabiel bij 4° C en een neutrale pH, maar ontbinden onmiddellijk wanneer ze in aanraking komen met zuren of alkaliën. Ontbonden NAD kan worden gebruikt als enzymremmer.[10]
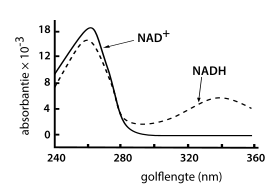
Zowel NAD+ als NADH absorberen ultraviolet licht door de aanwezigheid van adenine. De piekabsorptie van NAD+ ligt bij een golflengte van 259 nanometer, met een bijbehorende extinctiecoëfficiënt van 16.900 M–1 cm–1. NADH absorbeert ook hogere golflengtes: de tweede piek bevindt zich rond de 339 nanometer. De extinctiecoëfficiënt van NADH bedraagt 6.220.[11] Het verschil in absorptie tussen de geoxideerde en gereduceerde vorm van NAD maakt uv-spectroscopie een goede techniek voor enzymassays.[kleine-letter 4]
NAD+ en NADH verschillen ook in fluorescentie. Opgelost NADH heeft een emissiepiek van 460 nm met een fluorescentietijd van 0,4 nanoseconden. De geoxideerde vorm vertoont geen fluorescentie.[12] De mate van fluorescentie verandert wanneer NAD bindt aan eiwitten. Deze veranderingen kunnen gebruikt worden voor het meten van de dissociatieconstante, waarmee men de enzymkinetiek kan bestuderen.[12][13] Daarnaast worden de veranderingen gebruikt om de redoxtoestand van levende cellen te bepalen met behulp van fluorescentiemicroscopie.
Synthese
Synthese uit aminozuren
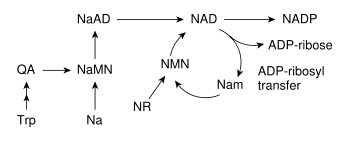
De meeste organismen kunnen NAD synthetiseren uit eenvoudige verbindingen.[6] Hoe de stofwisselingsroutes precies in elkaar zitten verschilt, maar een algemeen kenmerk is de vorming van de NAD-precursor chinolinezuur (QA). Chinolinezuur wordt in dieren en bepaalde bacteriën gevormd uit het aminozuur tryptofaan (Trp),[14] in planten en veel micro-organismen uit asparaginezuur.[15] Het gevormde chinolinezuur wordt vervolgens omgezet in nicotinezuur-mononucleotide (NaMN) door overdracht van een fosforibose. Toevoeging van adenylaat aan dit molecuul leidt tot de vorming van een dinucleotide, waarvan de ene nucleotide adenine en de andere nicotinezuur draagt, afgekort NaAD. Ten slotte wordt het nicotinezuur in NaAD geamideerd tot nicotinamide (Nam), zodat het functionele NAD ontstaat.[6]
NAD kan op zijn beurt ook worden omgezet in nieuwe verbindingen. NADP, een assimilerend co-enzym dat sterk lijkt op NAD, ontstaat door fosforylering (koppeling van een fosfaatgroep) van NAD door het enzym NAD+-kinase. Bij de meeste organismen is de fosfaatgroep afkomstig van het energiedragermolecuul ATP. Sommige bacteriën zoals Mycobacterium tuberculosis en de thermofiele archaeon Pyrococcus horikoshii gebruiken anorganisch polyfosfaat uit hun omgeving als fosfaatbron hiervoor.[16][17]
Synthese uit salvage
Sommige cellen zijn niet in staat om NAD de novo te synthetiseren uit aminozuurprecursors. Om toch aan nucleotiden te komen, ondergaan verbindingen die in structuur overeenkomen met NAD (namelijk moleculen met een voorgevormde pyridine-ring) een zogenaamde salvage-pathway, waarin NAD wordt gerecycled. Deze moleculen met pyridine kunnen gedeeltelijk afgebroken nucleotiden zijn of afkomstig zijn uit voeding. Salvage van NAD draagt bij aan een efficiënte productie en gaat verspilling tegen.
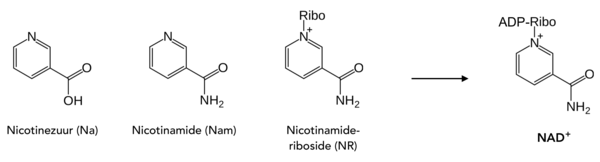
Een belangrijk voorbeeld van voorgevormde moleculen die in salvage-pathways worden gebruikt zijn de drie NAD-precursors nicotinezuur (Na), nicotinamide (Nam) en nicotinamideriboside (NR).[6] Dit zijn drie verschillende vormen van vitamine B3 en deze verbindingen, waarvan nicotinezuur het belangrijkst is, zijn enkel afkomstig uit voeding. De dagelijkse behoefte aan nicotinezuur voor biosynthese van NAD is minder dan 20 mg.[18] Doordat vitamine B3 in het lichaam snel wordt omgezet in het co-enzym, wordt dit vitamine ook wel gezien als het NAD-supplement.[19]
De enzymen die betrokken zijn bij nucleotiden-salvage concentreren zich rond de celkern, omdat rond en binnen de celkern veel reacties plaatsvinden waarin NAD+ wordt gebruikt.[20] Er zijn enkele onderzoeken die uitwijzen dat cellen van zoogdieren NAD+ kunnen opnemen uit het extracellulair milieu, en dat zowel nicotinamide als nicotinamideriboside geresorbeerd worden via de darmen.[21] De aanwezigheid van de vitamineprecursors in het cytoplasma stimuleert de aanmaak van NAD; de salvage-pathways worden in feite opgewekt door de aanwezigheid van de precursors. Een actieve stofwisseling van nucleotiden is dus bevordelijk voor een gezonde synthese van NAD.[22]
| In salvage-pathways fungeren onderstaande vitaminen als precursor van NAD+ |
 |
Ondanks dat het lichaam zelfstandig NAD uit aminozuren kan vormen, blijven salvage-pathways een essentieel onderdeel van de stofwisseling: een tekort aan vitamine B3 kan leiden tot de vitaminedeficiëntieziekte pellagra, een ziekte die in veel ontwikkelingslanden nog niet is uitgebannen.[23] Doordat er een voortdurend verbruik van het co-enzym is in reacties zoals posttranslationele modificatie,[kleine-letter 5] is er in alle lichaamscellen een aanhoudende behoefte aan NAD, zij het in lage concentraties.[14]
De salvage-pathways die in zoogdieren voorkomen verschillen van die in micro-organismen (bacteriën en eencellige schimmels).[24] Sommige ziekteverwekkende micro-organismen, zoals de gist Candida glabrata en de bacterie Haemophilus influenzae zijn niet in staat zelf NAD te synthetiseren, maar beschikken wel over salvage-pathways. Zij zijn geheel afhankelijk van een externe aanvoer van NAD of de directe precursors ervan.[25][26] Bij de intracellulaire pathogeen Chlamydia trachomatis zijn ook de salvage-pathways afwezig: de co-enzymen worden onttrokken aan de gastheercel.[27]
Fysiologie
De totale concentratie NAD, dus van NAD+ en NADH tezamen, varieert in lichaamscellen van ongeveer 0,001 tot 1 mM.[28] Van al het intracellulaire NAD is maar een klein deel vrij; het meeste is gebonden aan eiwitten. De concentratie vrij NAD wordt bij dieren geschat op 0,3 mM.[29][30] Bij micro-organismen zoals gisten is deze hoger, waarschijnlijk tussen de 1,0 en 2,0 mM.[31] De hoeveelheden NAD+ en NADH in cellen wordt gereguleerd door strikte controlemechanismen. De concentratie NAD in mitochondriën, de plek waar het co-enzym veel gebruikt wordt, blijkt ongeveer even hoog te zijn als in de rest van de cel.[30] Het overgrote meerendeel (tot wel 80%) van NAD is gebonden aan eiwitten, waardoor fluorescentiemetingen, die alleen het vrije NAD meten, veel lagere waarden aangeven dan wat de NAD-concentratie in werkelijkheid is.[32]
De verhouding tussen de geoxideerde en gereduceerde vorm van nicotamine-adenine-dinucleotide wordt de NAD+/NADH-ratio genoemd. Deze ratio geeft onder meer de redoxtoestand van een cel aan: een maat voor de stofwisselingsactiviteit en daarmee de gezondheid van een cel op een bepaald moment.[33] Wat de effecten zijn van een bepaalde NAD+/NADH-ratio is moeilijk te voorspellen: de ratio bepaalt de activiteit van enzymen (zoals pyruvaatdehydrogenase) die op hun beurt andere complexe fysiologische mechanismen in de cel beïnvloeden. In gezond zoogdierweefsel is de verhouding vrij NAD+/NADH binnen het cytoplasma ongeveer 700.[34][35] Er is dus een sterke bevordering richting oxidatieve reacties. De verhouding van de totale hoeveelheid (inclusief gebonden) NAD+ en NADH is echter veel kleiner dan 700; deze wordt geschat op 3–10.[36]
De mate waarin NAD+ en NADH zich ten opzichte van elkaar verhouden is van essentieel belang voor de stofwisseling, genexpressie, signaaltransductie en vele andere levensprocessen binnen de cel. Het uit balans raken van de verhouding is in verband gebracht met een veelheid aan pathologische aandoeningen, zoals hart- en vaatziekten, neurodegeneratieve ziekten, kanker en veroudering. Om deze aandoeningen te ondervangen, wordt het NAD-evenwicht in cellen dynamisch in stand gehouden door een wisselwerking van biosynthese, enzymatische afbraak, lokalisering en compartimentalisatie.
Functies
Nicotinamide-adenine-dinucleotide speelt een essentiële rol in verschillende processen van de stofwisseling. Het functioneert als co-enzym in honderden redoxreacties, als donor van ADP-ribosegroepen in ADP-ribosyleringsreacties, als directe precursor van het boodschappermolecuul cyclisch ADP-ribose en als een substraat voor DNA-ligasen en sirtuïnen die NAD+ gebruiken om acetylgroepen te verwijderen uit eiwitten. Naast deze metabole functies is NAD ook betrokken bij extracellulaire processen.[37]
Binding aan oxidoreductasen
De voornaamste functie van NAD+ is de overdracht van elektronen. Reacties waarin elektronenoverdracht plaatsvindt worden gekatalyseerd door een zeer grote groep enzymen, die oxidoreductasen worden genoemd.[kleine-letter 6] Tijdens een biochemische reactie gaan NAD en het substraat een binding aan met het enzym. Vervolgens vindt een redoxreactie tussen de twee moleculen plaats. De formele, volledige naam van een oxidoreductase bevat de namen van beide substraten: het molecuul dat elektronen verliest en het molecuul dat elektronen opneemt. Een voorbeeld is NADH—ubichinon-oxidoreductase. Dit enzym katalyseert de oxidatie van NADH en de reductie van ubichinon (beter bekend als co-enzym Q10).
Er zijn veel families van enzymen die NAD+ of NADH kunnen binden. De meeste van deze families kenmerken zich door een structuurmotief genaamd de Rossmann-vouwing.[38] Dit motief is vernoemd naar Michael Rossmann, die in 1970 ontdekte dat deze vouwingsstructuur (bestaande uit afwisselende bèta-platen en alfa-helices) veel voorkomt in nucleotide-bindende eiwitten.[39] Niet alle NAD-bindende eiwitten hebben een Rossmann-vouwing, een voorbeeld is het aminozuur-afbrekende enzym genaamd 2CWH dat voorkomt in Pseudomonas syringae.[40]
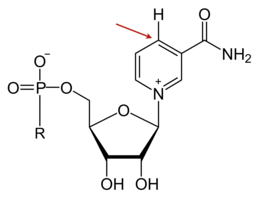
Wanneer NAD zich bindt aan het actieve centrum van een oxidoreductase, wordt de nicotinamide-ring zo gepositioneerd dat het een waterstofion van het substraat kan opnemen. Het vierde koolstofatoom (C4) van de ring neemt het waterstofion op, en dit kan vanuit twee oriëntaties. De koolstofatomen van de nicotinamide-ring liggen in een tweedimensionaal vlak. De hydride-donor kan zodoende "vóór" of "achter" dit vlak gepositioneerd zijn. Oxidoreductasen van klasse A dragen het hydride-ion over van voren; enzymen van klasse B van achteren.[kleine-letter 7]
Het C4-atoom dat het waterstofion accepteert is prochiraal, wat inhoudt dat NAD een chiraal molecuul kan worden (afhankelijk van welk element eraan zal binden). Prochiraliteit wordt gebruikt in enzymkinetisch onderzoek. Het te onderzoeken enzym wordt gemengd met een substraat dat deuterium (een isotoop van waterstof) bevat, zodat het enzym tijdens de reductie van NAD+ deuterium overdraagt in plaats van waterstof. Bij een dergelijk experiment ontstaan één of twee stereo-isomeren van NADH.[41]
Verreweg de meeste oxidoreductasen vertonen een hoge mate van specificiteit voor ofwel NAD+, ofwel NADP+, ondanks dat de co-enzymen op vergelijkbare wijzen aan het actieve centrum binden.[42] Deze specificiteit komt voort uit de subtiele verschillen in structuur van het actieve centrum, en heeft tot gevolg dat de co-enzymen functioneren bij totaal verschillende cellulaire processen. In het actieve centrum van NADP-afhankelijke enzymen wordt een ionaire binding gevormd tussen een basisch aminozuur en de zure fosfaatgroep van het NADP+. In NAD-afhankelijke enzymen is geen sprake van zo'n basisch aminozuur, waardoor binding met NADP niet mogelijk is. Dit is echter een algemene regel die niet altijd opgaat. Van sommige enzymen, zoals glucose-6-fosfaatdehydrogenase en aldosereductase, is aangetoond dat in bepaalde gevallen beide co-enzymen gebruikt worden.[43]
Redoxmetabolisme
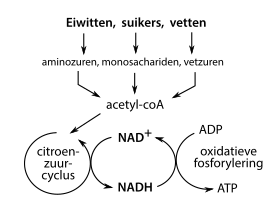
NAD-bindende enzymen zijn essentieel voor alle aspecten van de stofwisseling. Eén aspect van de stofwisseling in het bijzonder is het geheel aan reacties waarbij chemische energie wordt verkregen uit voedingsstoffen. In deze reacties worden energierijke verbindingen, zoals glucose en vetzuren, geoxideerd: ze staan hun elektronen af en geven daarmee energie vrij die het organisme nodig heeft om in leven te blijven. De energie wordt opgeslagen en overgedragen door middel van de omzetting van NAD+ in NADH, en vindt plaats in onder meer glycolyse, bèta-oxidatie en de citroenzuurcyclus. In eukaryoten wordt het NADH dat in het cytoplasma gevormd is, door een shuttlesysteem overgebracht naar het mitochondrion.[44] Na passage van het membraan wordt het mitochondriale NADH geoxideerd door de elektronentransportketen, dat protonen over het membraan transporteert en daarmee ATP genereert door middel van oxidatieve fosforylering.[45]
NAD wordt gebruikt als reducerend én oxiderend vermogen, waardoor een relatief hoge NAD+/NADH-ratio in cellen wordt gehandhaafd. In tegenstelling daartoe wordt NADP vrijwel uitsluitend als reducerend vermogen gebruikt, namelijk in stofwisselingsprocessen zoals vetzuursynthese en fotosynthese. De verhouding NADP+/NADPH in cellen wordt hiervoor relatief laag gehouden. Dit is mogelijk door een zeer negatieve standaardelektrodepotentiaal (minder dan –0,37 V), zodat het NADPH voornamelijk als elektronendonor reageert.[19]
NADH wordt naast bovenbeschreven katabolische reacties ook gebruikt in de gluconeogenese: de vorming van glucose uit eiwitten en vetten.[46] In zekere mate is NADH dus ook nodig voor de vorming van energierijke verbindingen, in plaats van enkel de afbraak ervan. Dit is een probleem voor nitrificerende bacteriën zoals Nitrobacter, die van voedingsstoffen leven waaruit kleine hoeveelheden energie kunnen worden verkregen. Nitrobacter oxideert nitriet tot nitraat en maakt daarbij net genoeg energie vrij om een protonengradiënt aan te leggen en ATP te genereren, maar niet genoeg om ook NADH te produceren, waardoor de gluconeogenese onvoldoende op gang komt.[47] Om toch in leven te blijven, gebruiken deze bacteriën een enzym dat de elektronentransportketen in omgekeerde richting laat verlopen, zodat het benodigde NADH wordt gevormd.[48]
Extracellulaire werking
Sinds de jaren 2000 is er meer aandacht gekomen voor het feit dat NAD ook functioneert als extracellulair signaalmolecuul in celcommunicatieprocessen.[37][49] In het verleden ging men ervan uit dat co-enzymen niet getransporteerd konden worden over de membranen van cellen. Er is echter vastgesteld dat NAD+ in kleine hoeveelheden vrijkomt uit de zenuwcellen in bloedvaten,[50] in de urineblaas[51] en in de dikke darm,[52] en daarnaast ook uit neurosecretoire cellen en synaptosomen in de hersenen.[53] Door deze relatie met het zenuwstelsel veronderstelt men dat NAD+ een neurotransmitter is die een inhiberende werking heeft op het glad spierweefsel van bepaalde organen.[54] In planten is het vrijkomen van NAD uit cellen in verband gebracht met het vegetatieve afweersysteem.[55] Er is nog veel onduidelijk over de precieze functies van extracellulair NAD. Het belang ervan voor de menselijke gezondheid en dat van andere organismen blijft onderwerp van wetenschappelijk onderzoek.
Overige functies
Het co-enzym NAD wordt buiten zijn rol als redoxmolecuul ook verbruikt in bepaalde metabole reactieketens. Een algemene stap in deze reactieketens is de splitsing van NAD in nicotinezuur en ADP-ribose.[kleine-letter 8] De enzymen die deze splitsing katalyseren worden ADP-ribosyltransferases genoemd. Het ontstane ADP-ribose vervult in de cel een aantal belangrijke functies.
Sommige nieuw gesynthetiseerde eiwitten hebben een ADP-ribose nodig om goed te functioneren. De koppeling van een ADP-ribose aan dergelijke eiwitten is een posttranslationele modificatie en wordt ADP-ribosylering genoemd.[56] In een ADP-ribosylering wordt ofwel een enkele ADP-ribose overgedragen (mono-ADP-ribosylering), ofwel een keten van meerdere ADP-ribosen aan het doeleiwit gehecht (poly-ADP-ribosylering). Mono-ADP-ribosylering is het werkingsmechanisme achter bepaalde bacteriële toxines: koppeling van ADP-ribose leidt vaak tot inactivering van het eiwit.[57] Poly-ADP-ribosylering is van belang bij DNA-reparatie, genregulatie, sturing van apoptose en het onderhoud van telomeren.[58] Er is ook een aantal extracellulaire ADP-ribosyltransferases ontdekt, maar de functies ervan zijn nog onduidelijk.[59]
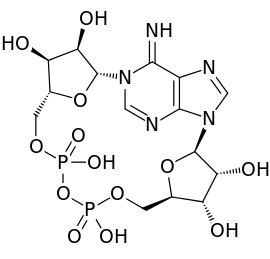
Cyclisch ADP-ribose
Een andere functie van ADP-ribose in celcommunicatie is zijn rol in de vorming van het boodschappermolecuul cyclisch ADP-ribose. Cyclisch ADP-ribose wordt gevormd uit NAD onder invloed van het enzym ADP-ribosylcyclase.[kleine-letter 9] Cyclisch ADP-ribose fungeert als second messenger (boodschappermolecuul) in calciumsignaaltransductie: na binding van een signaalmolecuul aan de buitenzijde van de cel zorgt cyclisch ADP-ribose ervoor dat binnen de cel calciumionen vrijkomen uit het endoplasmatisch reticulum, wat leidt tot een biologische respons. Het cyclisch ADP-ribose doet dit door te binden aan een klasse van calciumkanalen genaamd ryanodinereceptoren.[61] Na binding springen zij open.
Sirtuïnen en ligasen
NAD+ wordt verbruikt door de enzymfamilie van de sirtuïnen. Dit zijn enzymen die acetylgroepen uit eiwitten verwijderen en deze overdragen op de ADP-ribosedeel van NAD+; het co-enzym wordt dus gesplitst tot nicotinamide en O-acetyl-ADP-ribose. Sirtuïnen zijn hoofdzakelijk betrokken bij de regulatie van transcriptie (het aflezen van genen voor eiwitsynthese) door deacetylering van histonen. Histonen zijn eiwitten waaromheen het DNA is opgerold. Sirtuïnen kunnen het opgerolde DNA lokaal ontvouwen zodat genen kunnen worden afgelezen. Ook andere eiwitten kunnen door deze enzymen worden gedeacetyleerd. Sirtuïnen zijn in de belangstelling gekomen vanwege hun rol in de regulering van veroudering.[62]
Andere enzymen die NAD verbruiken zijn de bacteriële DNA-ligasen. Een ligase kan de uiteinden van twee DNA-ketens aan elkaar hechten. In bacteriën gebruiken ligasen daar het energierijke molecuul adenosinemonofosfaat voor. Het adenosinemonofosfaat wordt uit NAD+ gesplitst. De energie die daarbij vrijkomt wordt gebruikt om de ene DNA-streng te verbinden met de andere. Het ligase-enzym in eukaryoten (planten, dieren en schimmels) gebruikt hiervoor geen NAD, maar ATP.[63]
In 2017 werd aangetoond dat NAD is betrokken bij de nog grotendeels onbekende processen die veroudering en levensduur beïnvloeden.[2] Het onderzoek wees uit dat de afname in DNA-reparatie – die zich tijdens veroudering voordoet – verband houdt met een afname in NAD-concentraties binnen lichaamscellen. Een verandering in interacties tussen twee NAD-afhankelijke eiwitten, DBC1 en PARP1 genaamd, zouden een bepalende factor zijn in het verouderingsproces (door hun rol in DNA-reparatie). Het bijstellen van NAD+ kan op deze manier niet alleen veroudering tegengaan, maar ook bescherming bieden tegen het ontstaan van kanker, en tegen de schadelijke effecten van straling.[2]
Onderzoek
Farmacologie
Al tientallen jaren lang is het co-enzym NAD vanuit farmacologisch en therapeutisch oogpunt een belangrijk onderzoeksthema. Bij de ontwikkeling van nieuwe geneesmiddelen wordt NAD+ vanuit drie benaderingen onderzocht: als directe doelwitstof, als referentiemolecuul (leidverbinding) bij het ontwerpen van enzymremmers van NAD-afhankelijke enzymen, en bij inhibitie van de biosynthese van NAD in antibiotica.[64]
Omdat er veel oxidoreductasen bestaan die NAD+ gebruiken, wordt algemeen aangenomen dat enzymremmers die in structuur overeenkomen met NAD niet op één specifiek enzym inwerken, zoals gewenst. Er zijn echter een paar uitzonderingen ontdekt. Enzymremmers die gebaseerd zijn op mycofenolzuur inhiberen IMP-dehydrogenase aan de NAD+-bindingsplaats. Omdat IMP-dehydrogenase een belangrijke rol speelt in nucleotidenstofwisseling, kunnen deze enzymremmers gebruikt worden in de behandeling van kanker, de bestrijding van virussen en als immuunsuppressivum.[65]
Er zijn ook geneesmiddelen die de stofwisseling van NAD juist bevorderen. Met name de sirtuïnen zijn in de belangstelling gekomen vanwege hun levensverlengende werking bij sommige dieren. Moleculen als resveratrol verhogen de activiteit van sirtuïnen en hebben daarmee het vermogen om veroudering te vertragen in zowel ongewervelde als gewervelde modelorganismen.[66] In een onderzoek uit 2013 werd vastgesteld dat NAD de eiwitlokalisatie tussen de celkern en het mitochondrium verbetert, wat eveneens de gezondheid ten goede komt.[67]
Antibiotica
NAD+ is een directe doelwitstof van het antibioticum isoniazide, dat gebruikt wordt bij de behandeling van tuberculose, een infectieziekte van de bacterie Mycobacterium tuberculosis. Isoniazide is een prodrug dat pas actief wordt nadat het de tuberculosebacterie binnengaat. Het enzym peroxidase in deze bacteriën oxideert het medicijn tot een vrije radicaal. De isozianide-radicalen reageren met NADH en produceren daarbij zeer krachtige enzymremmers die de stofwisseling van de ziekteverwekker blokkeren.[68]
De bacteriële biosyntheseroutes van NAD verschillen van die in mensen en dieren. Ook dit is een belangrijk aangrijpingspunt voor de ontwikkeling van nieuwe antibiotica.[69] Een goed voorbeeld van een enzym dat voorkomt in bacteriën en schimmels maar afwezig is in mensen is nicotinamidase. Dit enzym, dat nicotinamide omzet in nicotinezuur, is essentieel voor de vorming van NAD en wordt daarom gezien als target voor nieuwe geneesmiddelen.[24]
Geschiedenis

Het co-enzym NAD werd voor het eerst beschreven in 1906 door de Britse biochemici Arthur Harden en William John Young.[70] Zij ontdekten dat het toevoegen van een gekookt, gefilterd gistextract aan ongekookt gistextract zorgde voor een grote toename in alcoholische fermentatie. Het bestanddeel in het gekookte extract dat hiervoor verantwoordelijk was, noemde ze het coferment. Na een langdurig en complex zuiveringsproces slaagde Hans von Euler-Chelpin erin om de nog onbekende stof te identificeren als een nucleotide-suikerfosfaat.[71] In 1936 toonde Otto Heinrich Warburg aan dat die stof betrokken was in redoxreacties en dat de nicotinamide-ring van het molecuul waterstofionen opneemt en afstaat.[72]
De precursors en biosyntheseroutes van NAD werden in beginnende mate ontdekt rond de jaren veertig. Conrad Elvehjem signaleerde in 1939 het belang van nicotinezuur en leverde sterk bewijs voor het feit dat dit vitamine gebruikt wordt om NAD te produceren.[73] Enkele jaren later publiceerde Arthur Kornberg een onderzoek waarin hij voor het eerst een enzym binnen de stofwisselingsroute identificeerde.[74] Pas in 1949 werd duidelijk dat NADH de verbindinde factor was tussen de citroenzuurcyclus en de oxidatieve fosforylering, en dus van groot belang was in de stofwisseling en bio-energetica. De biochemici Jack Preiss en Philip Handler maakten in 1959 bekend dat zij alle tussenproducten en enzymen binnen de biosyntheseroute hadden ontdekt.[75][76] De salvage-pathway van NAD is sindsdien ook bekend komen te staan onder de naam ‘Preiss-Handler-pathway’.
Zie ook
Noten
Bronnen
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Nicotinamide adenine dinucleotide op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar. Literatuurverwijzingen
Externe links
|
| Zie de categorie Nicotinamide adenine dinucleotide van Wikimedia Commons voor mediabestanden over dit onderwerp. |
| Dit artikel is op 3 oktober 2019 in deze versie opgenomen in de etalage. |