Oxidatieve fosforylering
De oxidatieve fosforylering of elektronentransportketen staat (samen met de citroenzuurcyclus) in het centrum van de stofwisseling van alle organismen die zuurstof gebruiken. Het proces speelt zich af in de mitochondria.
| Deel van een serie artikelen over |
 |
|---|
Ruimtelijke structuur van een enzym
Eiwit · Fosfolipide · Koolhydraat · Biopolymeer · Natuurproduct · Nucleïnezuur · Metaboliet · Sacharide · Vet · Vitamine
Anabolisme · Celademhaling · Eiwitsynthese · Katalyse · Fotosynthese · Katabolisme
Bio-informatica · Enzymologie · Genetica · Immunologie · Moleculaire biologie · Structuurbiologie |
|
|
| Portaal |
Volgens de chemiosmotische theorie werkt de oxidatieve fosforylering volgens de volgende principes:
- energierijke elektronen uit de citroenzuurcyclus geven hun energie af in een serie redoxreacties, waarbij uiteindelijk zuurstof wordt gereduceerd tot water.
- Deze energie wordt gebruikt om een protonengradiënt te creëren.
- Deze protonengradiënt drijft de synthese van ATP aan. ATP levert energie voor zeer veel enzymatische en cellulaire processen.
De fotofosforylering, onderdeel van de fotosynthese bij planten, is de nauw verwante tegenhanger van de oxidatieve fosforylering. Bij de fotofosforylering wordt met behulp van licht ATP gesynthetiseerd aan de hand van de oxidatie van water tot zuurstof.
De oxidatieve fosforylering verloopt via een aantal elektronendragers en 5 grote eiwitcomplexen. Deze complexen bevinden zich in de binnenmembraan van het mitochondrion. De complexen en de belangrijkste elektronendragers worden hieronder besproken.
Elektronendragers en complexen
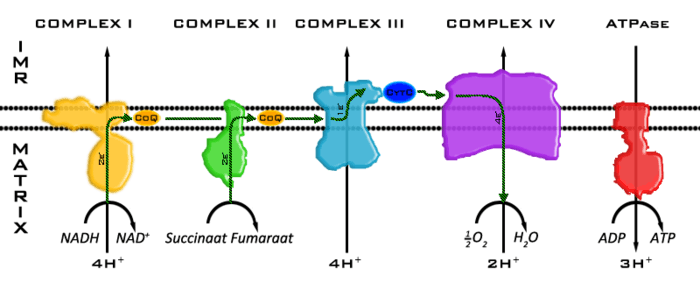
IMR=inter-membranaire ruimte, CoQ=Coënzyme Q, CytC=Cytochroom c.
- NADH
NADH (gereduceerd nicotinamide-adenine-dinucleotide) wordt onder andere in de glycolyse en de citroenzuurcyclus gevormd uit NAD+. NADH bevat twee zeer energierijke elektronen en transporteert deze naar complex I. Daarbij wordt het NADH weer omgezet tot NAD+.N
- Complex I
Complex I wordt ook wel NADH ubichinon-oxidoreductase genoemd. Het heeft een massa van 1.000 kiloDalton (kDa) en bestaat uit 44 subunits. Complex I is de belangrijkste toegangspoort van de oxfos. Complex I katalyseert 2 stoffen tegelijk.
- De overdracht van protonen en elektronen van NADH naar ubichinon-10 ook gekend als coënzyme q: NADH + H+ + Q → NAD+ + QH2. Het QH2 dat zo gevormd is, heet ubichinol. Dit ubichinol diffundeert door de binnenmembraan naar complex III.
- Het transport van vier protonen van de matrix naar de cristae in het mitochondrion. Dit draagt dus bij aan de vorming van de protonengradiënt. De energie voor dit transport wordt geleverd door de energierijke elektronen van NADH.
- Complex II
Complex II wordt ook wel succinaat-dehydrogenase genoemd. Het heeft een massa van 140 kDa en bestaat uit 4 subunits.
Complex II is het enige membraangebonden eiwit dat deel uitmaakt van de citroenzuurcyclus en een tweede toegangspoort tot de oxidatieve fosforylering. Het katalyseert de stap waarbij succinaat wordt geoxideerd naar fumaraat. Daarbij worden twee protonen en twee energierijke elektronen overgedragen naar Flavine-adeninedinucleotide (FAD), zodat FADH2 ontstaat. Via de ijzer-zwavelcentra in complex II worden de elektronen van FADH2 overgedragen aan ubichinone/coenzym Q10. Ook hierbij wordt ubichinol gevormd, dat diffundeert naar complex III. In tegenstelling tot complexen I, III en IV pompt complex II geen protonen naar de IMR en draagt zo dus niet bij aan de productie van ATP.
- Andere toegangspoorten
Naast complex I en II zijn er nog twee andere toegangspoorten tot de oxidatieve fosforylering. Ten eerste glycerol 3-fosfaat dehydrogenase ook glycerofosfaat shuttle genoemd, een enzym uit de glycolyse. Dit enzym is vergelijkbaar met complex II. Het oxideert glycerol 3-fosfaat naar dihydroxyaceton fosfaat en daarbij worden twee protonen en twee energierijke elektronen overgedragen naar FAD, zodat FADH2 ontstaat. Dit proces komt echter enkel voor in de vliegspieren van insecten op het moment dat deze veel energie consumeren. Ten tweede acyl-CoA dehydrogenase uit de bèta-oxidatie van vetzuren. Ook dit enzym werkt via FAD. Via twee andere enzymen worden de elektronen, die door deze toegangspoort binnenkomen, overgedragen aan ubichinon.
- Co-enzym Q10
Co-enzym Q10, ook bekend als CoQ10, Q10 of ubichinon-10 of kortweg Q genoemd, speelt een centrale rol in de oxidatieve fosforylering. Alle toegangspoorten tot de oxidatieve fosforylering komen uit op Q. Al co-enzymen Q moleculen hebben een kop en een staart. In de loop van de evolutie is de lengte van deze staart toegenomen van 2 isopreen-eenheden bij bacteriën tot 6 (CoQ6) als belangrijkste vorm bij de gist Saccharomyces cerevisiae, 8 (CoQ8) eenheden bij ratten en muizen, 9 bij knaagdieren en 10 (coenzym Q10) bij de meeste andere langlevende zoogdieren evenals bij de mens.[1]
- Complex III
Complex III wordt ook wel het cytochroom bc1-complex of ubichinon:cytochroom c oxidoreductase genoemd. Het is een peervormige homodimeer van 11 ondereenheden met een massa van 485kDa .
In complex III doorloopt ubichinol de zogenaamde Q-cyclus. Daarbij worden twee keer twee protonen getransporteerd van de matrix naar de cristae; en twee keer wordt cytochroom c1 gereduceerd. Het gereduceerde cytochroom c1 zal zijn elektron aan een cytochroom c molecule doorgeven. Dit kan doordat cytochroom c op cytochroom c1 bindt door interactie van geconserveerde Lysines die zich in een ring aan de buitenkant van cytochroom c bevinden. Het gereduceerde cytochroom c beweegt dan met zijn elektronen naar complex IV.
Complex III zal dus als een verdeler werken om de 2 elektronen van 1 co-enzym Q te verdelen over 2 cytochroom c die elk maar 1 elektron kunnen vervoeren.
- Complex IV
Complex IV wordt ook wel cytochroom oxidase genoemd. Het heeft een massa van 160 kDa en bestaat uit 14 subunits. De reductie van zuurstof tot water vergt vier elektronen. Deze zullen door het cytochroom c geleverd worden aan het Complex IV. koper- en heem-groepen in het complex kunnen 3 van deze elektronen opvangen en vervolgens aan zuurstof doorgeven. Het vierde elektron zal door een geconserveerd Tyr244 geleverd worden. Tyr zal hiervoor een tyrosine-radicaal (TyrO) vormen . Met deze vier elektronen en vier protonen uit de matrix wordt het zuurstof gereduceerd tot water. Tijdens deze reactie worden vier andere protonen gepompt van de matrix naar de cristae.
- Complex V
Complex V is een F-type ATPase en wordt uitgebreid besproken in het artikel ATPases.
Voorwaarden
Er zijn twee principiële voorwaarden voor de oxidatieve fosforylering. De eerste is dat de mitochondriale membraan intact moet zijn, zodat protonen alleen terug in de mitochondriale matrix kunnen komen door middel van ATP-synthase. De tweede is dat er een hoge concentratie van protonen tot stand moet komen aan de buitenkant van de binnenste membraan.
Bijzonderheden
Bij de oxidatieve fosforylering kunnen verschillende hoogreactieve, vergankelijke derivaten van zuurstof ontstaan. Dit zijn waterstofperoxide, superoxide en hydroxylradicalen. Een unieke functie van het cytochroom c oxidase, complex IV, is zijn mogelijkheid om controle te houden over de gevormde reactieve zuurstofsoorten als het zuurstof tot water reduceert.
Problemen
Er zijn een aantal dingen die mis kunnen gaan bij de oxidatieve fosforylering. Dit kan erg ernstige gevolgen hebben, omdat organismen zo afhankelijk zijn van dit proces voor hun energieproductie.
Er zijn toxische stoffen die invloed hebben op de oxidatieve fosforylering. Dit heeft niet alleen gevolgen voor de oxidatieve fosforylering zelf, maar voor de hele keten van de aerobe dissimilatie. Als één onderdeel van de keten misgaat, kan de rest ook niet meer doorgaan. Bijvoorbeeld, voeg oligomycine toe. Het resultaat hiervan is dat de H+-pompen geen protonen door kunnen laten omdat de concentratie te hoog voor ze wordt om nog protonen door te kunnen pompen. NADH en FADH2 zijn dan niet geoxideerd en de citroenzuurcyclus houdt op met werken omdat er geen NAD+ en FAD moleculen zijn om gereduceerd te worden.
- Cyanide onderbreekt de elektronentransportketen in de binnenste membraan van het mitochondrium omdat het sterker dan zuurstof aan het Fe3+ (ijzerion) in cytochroom a3 van complex IV bindt, waardoor voorkomen wordt dat dit cytochroom elektronen met zuurstof combineert.
- Oligomycine zorgt ervoor dat het ATP-synthase eiwit geen ATP meer kan maken van de protonen.
- CCCP(m-chloro-carbonylcyanide-phenylhydrazine) vernietigt de protonenconcentratie door ervoor te zorgen dat de protonen uit het membraan kunnen vloeien. Zonder de concentratie kan de ATP-synthase niet functioneren.
- Een detergent of een andere substantie die cellulaire membranen vernietigt door hun fosfolipide dubbellaag (celmembraan) af te breken zal het membraan dat gebruikt wordt bij de oxidatieve fosforylering afbreken en voorkomt zo een protonenconcentratie.
- Rotenon voorkomt de overdracht van elektronen van Fe-S centra in Complex I naar ubichinon. De elektronen die Complex 1 binnenkomen zijn afkomstig van NADH. Zij zorgen voor het grootste deel van het verminderde potentiaal naar de elektronentransportketen.
- Antimycine-A voorkomt de overdracht van elektronen van Complex III naar Complex IV.
- Koolstofmonoxide en azide binden zich onomkeerbaar aan Complex IV. Hierdoor kan het eiwit niet functioneren, wat chemische verstikking veroorzaakt.
- Dinitrofenol of 2,4-dinitrofenol(ook wel DNP) werkt als ontkoppelaar van de oxidatieve fosforylering. Het transporteert protonen over de membraan heen zonder hierbij ATP aan te maken.
Dit zijn slechts enkele voorbeelden van toxische stoffen die een grote invloed hebben op het proces van de oxidatieve fosforylering.
Men denkt dat defecten in de subunits van Complex I de oorzaak kunnen zijn van verschillende mitochondriale ziekten, zoals het syndroom van Leigh en de ziekte van Parkinson. In beschadigde mitochondriën, permeabel voor protonen, is de ATP-synthase werkzaam in omgekeerde volgorde, dus als ATPase. ATPase is een erg goede manier om ATP te ontbinden in ADP en Pi.
Bronnen, noten en/of referenties
|