Nitraat
Nitraat is de algemene naam van een polyatomisch anion (NO3−) of functionele groep (R-O-NO2) die één stikstofatoom en drie zuurstofatomen bevat. In nitraten heeft stikstof formeel een oxidatietoestand van +5. Chemisch gezien is salpeterzuur (HNO3) de stamverbinding van de nitraatgroep.
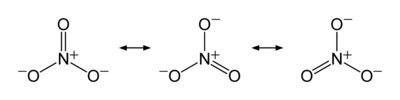
Nitraationen vormen met metalen altijd ionogene verbindingen, zeker met (aard-)-alkali-metalen. De verbindingen zilvernitraat en lood(II)nitraat zijn veelgebruikte stoffen in het laboratorium. Met alle metaalionen (en het ammonium-ion) vormt het nitraation opmerkelijk genoeg altijd een in water oplosbaar zout. Salpeterzuur is een krachtige oxidator. Nitraatesters zijn vaak zeer brandbaar en/of explosief.
Nitraten worden in de triviale naamgeving vaak als achtervoegsel salpeter genoemd:
- Kaliumnitraat: kalisalpeter of salpeter
- Calciumnitraat: kalksalpeter
- Ammoniumnitraat: ammoniumsalpeter
- Natriumnitraat: chilisalpeter
Toepassingen
Gebruik als kunstmest
Nitraatzouten worden ook gebruikt als kunstmest, omdat het anion stikstof bevat. Meestal gaat het hier om ammonium- en natriumnitraat. KAS (kalkammonsalpeter) bestaat uit zo'n 70% ammoniumnitraat (NH4NO3), 25% calciumcarbonaat (CaCO3) en de rest uit magnesiumoxide (MgO). Ook bestaan er mengmeststoffen (NPK) waarin behalve nitraat of ammonium (N) ook andere meststoffen zijn toegevoegd zoals fosfaat (P) of Kalium (K). Ook chilisalpeter (voor circa 95% NaNO3) wordt gebruikt. De naam verwijst naar de vroegere vindplaats. Het werd alleen maar in de Chileense woestijn gevonden, omdat er daar zo goed als geen neerslag valt en de lucht zeer droog is. Chilisalpeter is namelijk zeer hygroscopisch en wordt daarom in andere klimaten niet in de natuur gevonden. Nitraat wordt ook vaak toegewend in de vorm van ammonium, ureum of zelfs via injectie van vloeibare ammoniak. Vaak heeft dat als voordeel dat de nitraat langzamer vrij komt omdat ammonium eerst door nitrificerende bacteriën moet worden omgezet tot nitraat. Ook heeft ammonium voor bepaalde gewassen het voordeel dat de pH lager is.
Ondanks de vele vormen van N-meststof, van nitraat tot ureum en van organisch tot anorganisch gelden voor alle verschillende stikstofbronnen een zelfde rekeneenheid, namelijk het deel van de massa te wijten aan de stikstof atomen. Bijvoorbeeld, 100 kg nitraat NO3− wordt aangegeven als 23 kg zuivere stikstof.
Nitraat maakt onderdeel uit van de stikstofkringloop. De bron van nitraat en andere N-meststoffen wordt gevormd door luchtstikstof (N2) waar de lucht voor 80 % uit bestaat. Nitraat kan op natuurlijke wijze ontstaan zoals door stikstofbinding in wortelknolletjes in vlinderbloemigen en als NOx gevolg van een evenwichtsreactie tussen zuurstof en luchtstikstof bij bliksemontladingen. Daarnaast vindt deze evenwichtsreactie ook plaats bij natuurlijke branden en verbrandingsprocessen in bijvoorbeeld ketels en verbrandingsmotoren. Nitraatverlies vindt plaats door opname door planten, uitspoeling door overvloedige regenval en door denitrificatie als, als gevolg van een slechte bodemstructuur, bepaalde bacteriën de zuurstofatomen in het nitraat gebruiken. Bij denitrificatie verdwijnt de nitraat dan ook in de vorm van luchtstikstof weer in de atmosfeer wat de stikstofkringloop rond maakt.
Gebruik in het laboratorium
Nitraten worden in het laboratorium veel gebruikt omdat er geen onoplosbare verbindingen gevormd worden met metaalionen. Kaliumnitraat wordt toegepast in zoutbruggen, lood(II)nitraat is het loodzout en zilvernitraat speelt een belangrijke rol in de bepaling van halogeniden, met name chloride. Ook worden er veel fotografische proeven mee gedaan. Als men een oplossing natriumchloride (NaCl) toevoegt aan een oplossing van zilvernitraat (AgNO3) ontstaat zilverchloride (AgCl) dat niet oplosbaar is in water en direct zal neerslaan, waardoor het makkelijk is af te filtreren. Gezien de eigenschap van zilverchloride om direct te ontleden bij blootstelling aan daglicht in zilver (Ag) en chloorgas, (Cl2) wordt zilvernitraat gebruikt als basis voor deze proeven.
Precipitatiereacties
Nitraten van overgangsmetalen zijn over het algemeen goed oplosbaar in water. Dat maakt ze geschikt om onoplosbare zouten van overgangsmetalen op een gecontroleerde manier te maken met een precipitatiereactie. Bijvoorbeeld het niet in water oplosbare koper(II)carbonaat kan gemaakt worden door een oplossing van koper(II)nitraat en een oplossing van natriumcarbonaat met elkaar te mengen:
- Cu(NO3)2 (aq) + Na2CO3 (aq) → CuCO3 (s) + NaNO3 (aq)
Gebruik in vuurwerk en explosieven
Er bestaan pyrotechnische knallers die "nitraat" worden genoemd. Dit is echter een incorrecte benaming want deze bevatten altijd een mengsel van kaliumchloraat of kaliumperchloraat, aluminiumpoeder en soms zwavel en salpeter, ook wel kaliumnitraat genoemd.
Nitraatzouten vormen vaak de oxidator en/of het vlamkleurend ingrediënt in pyrotechnische sassen. Het meest gebruikt worden kalium-, barium- en strontiumnitraat. Strontium kleurt rood wanneer een chloordonor in de sas aanwezig is. Hiervoor wordt meestal PVC gebruikt. Barium kleurt helder groen (zie ook vlamkleuring). Ammonium- en natriumnitraat worden zelden gebruikt in sassen omdat ze zeer hygroscopisch zijn.
Ammoniumnitraat en zilvernitraat (NH4NO3) zijn de enige nitraatzouten die zonder enige bewerkingen kunnen worden gebruikt als secundaire explosieven. Ammoniumnitraat is echter zeer stabiel en dus zeer moeilijk te detoneren. Om de stof gevoeliger te maken wordt soms benzine, kerosine of dieselolie met de stof gemengd. Het zo verkregen explosief heet ANFO. Het is een veilig en zeer krachtig explosief. Om die reden heeft het in de mijnbouw dynamiet al bijna verdrongen. Er is echter nog wel een booster nodig om het explosief te detoneren. Hiervoor wordt meestal nog wel dynamiet gebruikt. Zilvernitraat daarentegen is een drukgevoelig explosief en is dus te detoneren met de klap van een hamer. Zilvernitraat wordt in de pyrotechniek niet zoveel gebruikt omdat het heel snel detoneert; het wordt wel gebruikt in zogenoemde knalerwten. Soms worden nitraatzouten gemengd met nitromethaan. Hiervoor wordt meestal ammonium- of kaliumnitraat gebruikt. Het nadeel van deze explosieven is dat ze veel minder stabiel zijn dan ANFO. De verkregen explosieven heten respectievelijk ANNM (bij ammoniumnitraat) en PNNM (bij kaliumnitraat).
Productie
In de industrie wordt meestal salpeterzuur als beginstof genomen om een nitraatzout te maken. Salpeterzuur wordt gevormd uit ammoniak en zuurstofgas via de volgende globale reactie:
NH3 + 2 O2 → HNO3 + H2O
Deze reactie verloopt in werkelijkheid in een drietal stappen:
1. 4 NH3 + 7 O2 → 4 NO2 + 6 H2O
2. 3 NO2 + H2O → 2 HNO3 + NO
3. 2 NO + O2 → 2 NO2
Er is een Pt-katalysator nodig voor reactiestap 1, omdat anders in plaats van HNO3 het onbruikbare N2 gevormd wordt.Het in stap 3 gevormde NO2 laat men via recirculatie van het gas weer stap 2 ondergaan.
Daarna kan salpeterzuur worden omgezet in nitraten. In de meeste gevallen laat men het ontstane salpeterzuur nogmaals reageren met ammoniak waardoor ammoniumnitraat ontstaat. In het lab kan kaliumnitraat meestal uit kaliumcarbonaat (K2CO3) of kaliumchloride (KCl) worden gemaakt of in sommige gevallen uit metallisch kalium, maar dit reageert zeer agressief met het HNO3. In de industrie maakt men simpel gebruik van een zuur-base reactie tussen een carbonaat of hydroxide met ammoniumnitraat.
Bij de productie van nitraatesters wordt nitreerzuur gebruikt, een 50/50-mengsel van zwavelzuur en salpeterzuur. Organisch materiaal (koolhydraten, niet-aromatische amines) wordt in het zuur gelegd waardoor in een chemische reactie de ONO2-groep zich aan het organische molecuul hecht. Zo'n reactie wordt een nitrering genoemd (niet te verwarren met aromatische nitrering). Aromatische gesubstitueerde verbindingen kunnen ook genitreerd worden maar vormen nitroverbindingen (RNO2). Esters van salpeterzuur zijn zeer brandbaar of explosief. Hooggenitreerde varianten kunnen in de open lucht in bepaalde hoeveelheden al tot detonatie overgaan (voorbeelden: cellulosenitraat en nitrozetmeel). Ook suikers als sacharose kunnen genitreerd worden.
Nitraat in de plantenstofwisseling
Nitraten spelen een belangrijke rol bij stikstofopname door de plant uit de bodem. Bemesting levert de plant een stikstofvoorraad, die onder andere in de vorm van nitraat opgelost in bodemvocht, via de plantenwortels opgenomen wordt. De plant zet nitraten om in eiwitten voor zijn groei. De uiteindelijk door planten opgenomen hoeveelheid nitraat wordt beïnvloed door:
- Licht
- Temperatuur
- Bemesting via kunstmest (in de land- en tuinbouw)
Als de plant zijn nitraatbehoefte heeft verzadigd hoopt bij overvloedige bemesting nitraat zich op in de bodem. Dit speelt met name bij geringe groei en weinig productie van assimilaten (suikers en eiwitten) van diverse groenten, zowel blad- als knolgewassen. In geval van langdurige overbemesting vormt nitraat, door uitspoeling via het regenwater in het grondwater, tenslotte een probleem bij de bereiding van schoon drinkwater (zie hieronder onder 'drinkwater' en onder 'risico's'). Bovendien ontstaat er ook een overmaat aan nitraat in de plant zelf, als er meer nitraten worden opgenomen dan in eiwit omgezet. Uiteindelijk worden zo groenten gevormd met een (te) hoog nitraatgehalte.
Nitraat in voeding
De drie belangrijke bronnen van nitraat in de voeding zijn groenten, conserveermiddelen en drinkwater. De aanvaardbare norm is vastgesteld op 259 mg voor een volwassene van 70 kilo.[1] Deze hoeveelheid is voor 75 tot 90% afkomstig van groenten. Conserveermiddelen en drinkwater maken samen gemiddeld ongeveer 15 tot 20% van de inname uit. De gemiddelde inname in Europa zou 155 mg per dag zijn.[2]
- Groenten
Nitraten komen van nature veel voor in groen voedsel. Voorbeelden van groenten waar meer dan 1 gram nitraat per kilogram in voorkomt zijn:
De hoeveelheid nitraat in groenten is seizoensafhankelijk. In de winter is die ongeveer anderhalf keer zo groot als in de zomer. Gemiddeld bevat een kropsla in de winter gemiddeld 3,2 gram tegen 2,2 gram per kilogram in de zomer. Maar ook bij voorjaarsspinazie en veldsla kunnen hoge nitraatgehaltes voorkomen, evenals bij andijvie, raapstelen, kool, bietjes, rucola, postelein en selderij. De overheid heeft per gewas en tijdsperiode van het jaar nitraatnormen opgesteld om vermarkt te mogen worden. Zo mag sla 's-zomers 2500 mg nitraat/kg bevatten en van 1 november tot 1 mei 4500. De overheid streeft naar een nitraatnorm van maximaal 2500 mg per kg groente.
- Conserveermiddelen
Nitraten worden tevens toegevoegd als conserveringsmiddel aan kaas en vleeswaren. Daarbij gaat het om natriumnitraat en kaliumnitraat (E-nummers respectievelijk E251 en E252). De nitraatzouten voorkomen de ontwikkeling van de bacterie die botulisme veroorzaakt. In vleeswaren zorgen ze bovendien voor de mooie roze kleur van het product.
- Drinkwater
Wanneer de bodem intensief bemest wordt, komt het nitraat na verloop van jaren uiteindelijk in het grondwater terecht. In gebieden waar grondwater wordt gebruikt als grondstof voor drinkwater blijkt dit water steeds meer nitraat te bevatten. Boven zandgronden in zuid- en oost Nederland komen nitraatgehaltes van 20–50 mg per liter voor.
Nitraat is bij drinkwaterbereiding heel moeilijk te verwijderen. Een mogelijkheid zijn ionenwisselaars waar het verwisseld kan worden met het chloor-ion. De nitraatnorm kan alleen voldaan worden door de vervuiling aan te pakken bij de bron, zoals het voorkomen van overbemesting en de vermindering van de uitstoot van NOx.
Nitraat wordt in het lichaam van de mens gerecirculeerd tussen de darm, het bloed en het speeksel omwille van de antibacteriële werking van nitriet.
Risico's
De schadelijkheid van nitraat is op zich niet hoog. Een probleem kan echter wel ontstaan bij de omzetting in het veel giftiger nitriet door bacteriën. De omzetting van nitraat naar nitriet vindt in de levensmiddelen zelf al plaats, maar dit gaat heel langzaam. Deze reactie verloopt echter sneller bij een hogere temperatuur, vooral tussen de tien en zestig graden Celsius. Boven een temperatuur van 60 graden gaan de bacteriën dood en vindt geen nieuwe nitrietvorming meer plaats. Omdat de temperatuur tijdens het kookproces echter langzaam oploopt is vorming van nitriet bij het koken van groenten dan ook niet te voorkomen. Het is dus raadzamer de te bereiden groente aan kokend water toe te voegen. Een kleine fractie (ongeveer 5%) van het ingenomen nitraat wordt tijdens de spijsvertering, door de bacteriën in het maag-darmkanaal omgezet in nitriet.
Deze nitrieten kunnen in bepaalde omstandigheden omgezet worden in nitrosaminen die mogelijk kankerverwekkend (met name maagkanker) zijn. Nitraatinname via de voeding leidt echter niet tot een verhoogd risico op maagkanker.[3][4]
Nitrieten kunnen in het bloed hemoglobine omvormen tot methemoglobine. Dit kan leiden tot anemie en cyanose. Bij baby's kan het percentage nitraat dat in het lichaam wordt omgezet in nitriet, oplopen tot tachtig procent. Bij zuigelingen kan daarom relatief gemakkelijk een zuurstoftekort (cyanose, methemoglobinemie, blauwzucht, blauwe-baby-ziekte) ontstaan. Babyvoeding was lange tijd uit voorzorg nitraatarm, maar dat advies is in 2014 herzien.[4] Bij een inname onder 15 mg nitraat per kg lichaamsgewicht per dag is er geen verhoogd risico. Ook het advies om geen nitraatrijk drinkwater te gebruiken bij de bereiding van zuigelingenvoeding is grotendeels ingetrokken.[4] Alleen wanneer water uit privébronnen wordt gebruikt bij de bereiding van zuigelingenvoedsel bestaat er een risico voor methemoglobinemie. In West-Europa komt methemoglobinemie bijna niet meer voor.[4][5]
De "aanvaardbare dagelijkse inname" (ADI) van nitraat is 3,7 mg/kg lichaamsgewicht per dag.[4]
Veel voorkomende nitraten
Organische nitraten
- Nitroglycerine (glyceryltrinitraat)
- Nitrocellulose(cellulosenitraat)
- Nitrozetmeel (zetmeelnitraat)
Bij een molecuulformule van een organisch nitraat wordt nooit NO3 geschreven, maar ONO2, daar één zuurstofatoom deel uitmaakt van een esterbinding. Een organisch nitraat kan bijgevolg opgevat worden als een nitro-ester.
Externe link
- Mest Actieplan (Kaarten met nitraatconcentraties in het oppervlaktewater in Vlaanderen)
Bronnen, noten en/of referenties
|