Ionaire binding
Een ion(aire)- of ionenbinding, ook wel elektrovalente of heteropolaire binding genoemd, is een binding die ontstaat door de elektrostatische aantrekking tussen een negatief en een positief geladen ion. De binding is alleen mogelijk tussen atomen met een groot verschil in elektronegativiteit. In de praktijk gaat het dan om bindingen tussen atomen met een metaalkarakter en atomen met een niet-metaalkarakter. De aantrekkingskracht van de ionen is de belangrijkste drijvende kracht. De sterkste ionbinding komt, praktisch gezien, voor in cesiumfluoride, omdat cesium en fluor het grootste verschil vertonen in elektronegativiteit, respectievelijk 0,79 en 3,98.
| Chemische binding |
|---|
| Dipool-dipoolinteracties
|
Moleculen (intramoleculair)
Moleculen (intermoleculair)
Zouten Metalen Covalente netwerken Theorieën Eigenschappen |
| Portaal |
Een ionbinding is een intermoleculaire noch een intramoleculaire kracht.
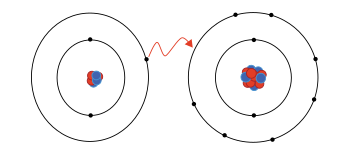
De ionbinding werd rond 1916 door Albrecht Kossel beschreven. De elementen-atomen streven in hun buitenste elektronenschil de edelgasconfiguratie s2p6, bij hogere chemische elementen vanaf gallium ook een gesloten s2p6d10 elektronenconfiguratie, na. Dit kan door ofwel elektronenafgifte worden bereikt, waarbij eenvoudig of meervoudig positief geladen kationen ontstaan, ofwel door elektronenopname, waarbij eenvoudig of meervoudig negatief geladen anionen ontstaan.
Er worden geen moleculen gevormd, maar wel een starre kristalstructuur met een dichte stapeling van de ionen. Deze ionen komen in waterige oplossing in gehydrateerde toestand voor. De sterkte van de binding is omgekeerd evenredig met de onderlinge afstand van de ionen in de kristalstructuur.
Voorbeelden
Eigenschappen ionaire verbindingen
Ionaire verbindingen zijn elektrisch neutraal. Ze hebben geen netto lading. Door de sterke ionaire bindingen binnen hun kristalrooster zijn deze stoffen bros, en niet kneed- of vervormbaar. Ze geleiden stroom niet in vaste aggregatietoestand, maar hun elektrische geleidbaarheid neemt sterk toe als ze in gesmolten of in opgeloste toestand verkeren. De kristalstructuur wordt verbroken en de ladingdragers, de kationen en de anionen, kunnen dan vrij bewegen.
Super-ionaire geleiders, bijvoorbeeld AgI, geleiden wel goed in vaste toestand. Ze hebben een hoog smeltpunt en een hoog kookpunt. Deze laatste is zó hoog, dat de damp uit ionaire moleculen in plaats van aparte ionen bestaat.
Tabel
De eigenschappen van enkele ionaire verbindingen:
| verbinding | smeltpunt (°C) | kookpunt (°C) |
|---|---|---|
| CsBr | 636 | 1300 |
| NaI | 661 | 1304 |
| MgCl2 | 714 | 1412 |
| KBr | 734 | 1435 |
| MgO | 2852 | 3600 |