Reductie (scheikunde)
Reductie is het scheikundige proces waarbij een stof (de oxidator) elektronen opneemt van een andere stof (de reductor). De oxidator wordt als het ware gereduceerd tot een reductor. Reductie vindt nooit op zichzelf plaats; de elektronen moeten immers ergens vandaan komen. Reductie is dus altijd slechts de helft van het gehele proces, de andere helft is de oxidatie. Waar een deeltje elektronen opneemt (reductie), staat er dus ook een deeltje elektronen af (oxidatie). Om die reden spreekt men van een zogeheten redoxreactie.
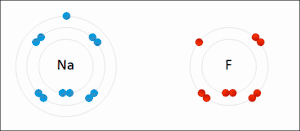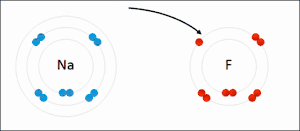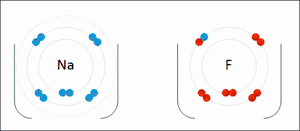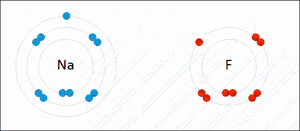
Een stof die in staat is een andere stof te reduceren wordt een reductor genoemd. De stof die gereduceerd wordt neemt de elektronen op en is dus de oxidator. De oxidator wordt gereduceerd, de reductor wordt geoxideerd. Omdat na het opnemen van elektronen deze ook weer afgestaan kunnen worden ontstaat tijdens de reductie uit de oxidator een reductor.
De term reductie is eerst gebruikt om de bereiding van metalen te beschrijven. Door de massa van het erts te reduceren (oftewel verminderen) werd het metaal verkregen. Na ontwikkeling van de ionentheorie was het ook mogelijk reductie te beschrijven als het verminderen van de lading van de metaalionen. Uiteindelijk heeft reductie een bredere betekenis gekregen: het afstaan van elektronen.
Voorbeelden
Als alleen naar het reductiegedeelte van een redoxreactie gekeken wordt, spreken we van een halfreactie van de reductie. De andere helft van de reactie, de oxidatie, laten we immers buiten beschouwing.
IJzer maken
- Fe3+ + 3 e− → Fe(s)
In ertsen komt ijzer meestal als Fe3+ voor, doorgaans als oxide of carbonaat. In hoogovens wordt koolmonoxide als reductor toegevoegd waardoor het metaal ijzer ontstaat.
IJzer(II)zouten
In plaats van tot het metaal ijzer kan Fe3+ ook tot Fe2+ gereduceerd worden.
- Fe3+ + e− → Fe2+
Fe3+ is de oxidator die het elektron opneemt en daarmee gereduceerd wordt tot Fe2+. Het ontstane Fe2+-ion is een speciaal deeltje. In tegenstelling tot Fe3+, dat alleen gereduceerd kan worden, en het metaal ijzer, dat alleen geoxideerd kan worden, kan Fe2+ zowel geoxideerd als gereduceerd worden.
Sommige bacteriën zijn ook in staat deze reactie uit te voeren. In plaats van zuurstof wordt Fe3+ gebruikt als elektronenacceptor. Vaak wordt ook sulfaat omgezet in sulfide. Het ontstane Fe2+ reageert met het ook gevormde S2− tot FeS. De zwarte kleur die je minder dan een schep diep in het natte strand of het wad ziet, is daarvan het gevolg
- Fe2(SO4)3 + 16 H + + 18 e− → 2FeS + SO42− + 8 H2O
Elektrolyse
In de elektrolyse lijkt het alsof er pure reductie plaatsvindt. Als je alleen kijkt naar de negatieve elektrode dan schijnt dat te kloppen. Op de kathode ontstaat het metaal uit zijn zout. Voor een elektrolyse zijn echter altijd twee elektrodes nodig. Aan de anode vindt een oxidatie plaats.
Deze methode van reductie wordt toegepast bij zeer onedele metalen als aluminium, de alkali- en de aardalkali-metalen worden op deze manier bereid uit hun zouten.
Organische chemie
In de organische chemie gaat de opname van elektronen vaak samen met de opname van waterstofatomen en soms het verlies van zuurstof uit het molecule. De stof met de meeste waterstofatomen is dan in hogere mate gereduceerd. Een voorbeeld is hiernaast weergegeven met de reductie van koolstofdioxide (O=C=O), via mierenzuur, methanal, methanol naar methaan (CH4). De stoffen hieronder staan zo gerangschikt dat de onderste stof het meest gereduceerd is.