Amine
Met een amine kan in de chemie zowel een atoomgroep als een stof bedoeld worden.
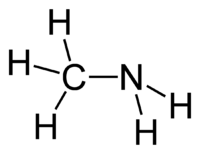
Atoomgroep
.png) Primair amine |
.png) Secundair amine |
.png) Tertiair amine |
Een amine is een functionele groep bestaande uit een stikstofatoom met daaraan gebonden drie koolstof- en/of waterstofatomen. Afhankelijk van het aantal koolstofatomen spreekt men van een:
- primair amine: aan het stikstofatoom is één alkylgroep gebonden (en twee waterstofatomen).
- secundair amine: aan het stikstofatoom zijn twee alkylgroepen gebonden (en één waterstofatoom).
- tertiair amine: aan het stikstofatoom zijn drie alkylgroepen gebonden (en geen waterstof).
Dit wordt genoteerd als alkyl(a)-alkyl(b)-alkyl(c)-amine (tertiair amine), analoog wordt secundair amine genoteerd als alkyl(a)-alkyl(b)-amine en primair amine als alkyl-amine.
Er wordt ook gesproken over eenwaardige (1 aminofunctie, bijvoorbeeld 2-butylamine), tweewaardige (2 aminofuncties op 2 verschillende C-atomen, bijvoorbeeld diaminoethaan) en driewaardige aminen (3 aminofuncties op 3 verschillende C-atomen, bijvoorbeeld 1,2,3-triaminopropaan).
Net als bij de alkanolen zijn diamines met de aminogroepen aan hetzelfde koolstofatoom meestal niet stabiel.
Stof
Een organische chemische verbinding met een aminogroep wordt ook amine genoemd.
Ruimtelijke structuur

Aminen lijken in structuur op ammoniak, NH3. De omringing van het stikstofatoom is niet vlak, maar het stikstofatoom vormt een driehoekige piramide. Dit heeft te maken met het feit dat stikstof een vrij elektronenpaar draagt, dat relatief meer ruimte inneemt dan de waterstoffen. Hierdoor treedt er sp3-hybridisatie op, wat de piramidale vorm verklaart. Het vrij elektronenpaar op stikstof kan in de meeste gevallen doorklappen, de zogenaamde stikstofinversie.
Eigenschappen
Ammoniak-achtig
Niet alleen de structuur van aminen lijkt op ammoniak. Ook de eigenschappen van aminen en ammoniak zijn vergelijkbaar. Net als ammoniak kunnen Amine-verbindingen waterstofbruggen doneren, en accepteren. Ze zijn ook basisch: ze kunnen, net als ammoniak, een extra H+ kation opnemen en daarmee samen een positief geladen groep vormen. Zo'n geladen groep kan alleen nog sterke waterstofbruggen doneren, niet meer accepteren.
Geur
Aminen hebben een sterke, onaangename geur (ammoniak, rotte vis).
Toepassingen
- Als organische base (worden in contact met carbonzuren omgezet in amiden);
- Tri-ethylamine is een veel gebruikte basische stof in de organische synthese
Voorbeelden
De eenvoudigste amine is methylamine. De eenvoudigste aromatische amine is aniline. Aniline wordt gebruikt bij de productie van kleurstoffen en geneesmiddelen.
| Zie de categorie Amines van Wikimedia Commons voor mediabestanden over dit onderwerp. |