Lysine
Lysine (afgekort als Lys, K) is een basisch, natuurlijk voorkomend aminozuur. Het is een van de twintig α-aminozuren die in alle organismen gebruikt wordt voor de synthese van eiwitten. De zijketen van lysine bestaat uit een lange alifatische staart eindigend in een aminogroep, die onder fysiologische omstandigheden positief geladen is. Lysine wordt gecodeerd door de codons AAA en AAG.
L-Lysine
| ||||
| Structuurformule en molecuulmodel | ||||
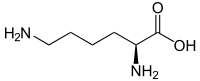 | ||||
Structuurformule van L-lysine | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C6H14N2O2 | |||
| IUPAC-naam | L-lysine | |||
| Molmassa | 146,18756 g/mol | |||
| SMILES | C(CCN)C[C@@H](C(=O)O)N | |||
| CAS-nummer | 56-87-1 | |||
| EG-nummer | 200-294-2 | |||
| PubChem | 5962 | |||
| Beschrijving | Witachtig poeder | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Smeltpunt | 224 °C | |||
| Oplosbaarheid in water | 300 g/l | |||
| Goed oplosbaar in | water | |||
| Nutritionele eigenschappen | ||||
| Essentieel? | Ja | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Lysine wordt geclassificeerd als een voor mens en dier essentieel aminozuur: het kan enkel uit voeding worden verkregen. Lysine is vooral aanwezig in dierlijke producten (vlees, vis en gevogelte). In mindere mate komt het voor in eieren, peulvruchten en zuivelproducten.[1] Naast eiwitsynthese is lysine van belang bij de versteviging van collageen en de vorming van carnitine voor vetzuursynthese. Lysine is eveneens betrokken bij de modificatie van histonen en daarmee in de regulering van het epigenetica.
Een tekort aan lysine kan bij de mens leiden tot verschillende ziekten, waaronder defecte bindweefsels, verminderde vetzuurstofwisseling, bloedarmoede en systemische eiwit-energie-deficiëntie.[2][3] Een overvloed aan lysine in het lichaam, bijvoorbeeld door een ineffectieve afbraak, kan ernstige neurologische problemen veroorzaken.[4]
Biosynthese
Planten en micro-organismen kunnen lysine de novo synthetiseren uit eenvoudige precursors. Er zijn twee biosyntheseroutes ontdekt die starten uit de verbindingen α-ketoglutaraat en aspartaat.
Eigenschappen
Lysine is een relatief groot aminozuur met een eenvoudige structuur. Mensen en dieren kunnen het zelf niet maken en moeten het daarom uit hun voeding opnemen. Het behoort daarom tot de essentiële aminozuren. Varkens, kippen en runderen krijgen lysine bijvoorbeeld als voedersupplement.[5]
Lysine vertoont, net als de meeste andere aminozuren (behalve glycine), optische isomerie waardoor twee configuratie is van het lysinemolecule mogelijk zijn: D (Dextro) en L (Laevo). Alleen de L-vorm is fysiologisch actief.[1]
De algemene formule R-CH(NH2)-COOH waarbij R=-CH2-CH2-CH2-CH2-NH2.
Toepassingen
Het overgrote deel van het industrieel geproduceerde lysine dient als veevoederadditief, maar daarnaast heeft het ook een aantal andere toepassingen. Zo zit het met andere aminozuren in infuusoplossingen en krachtdrankjes voor bodybuilders. In een hoofdpijntablet helpt het om de bloed-hersenbarrière te slechten en het medicijn dus op de juiste plaats in het lichaam te krijgen. Ook zijn er voedingssupplementen verkrijgbaar die beweren een uitbraak van het herpes simplex-virus te verminderen en voorkomen, maar hier is geen onomstotelijk bewijs voor. Tot slot bevatten een aantal cosmeticaproducten lysine.
Prof. John W. Frost van de Michigan State University heeft een methode ontwikkeld om L-lysine om te zetten in ε-caprolactam, de grondstof van het polyamide nylon-6. De methode bestaat uit de cyclisatie van L-lysine tot α-amino-ε-caprolactam, gevolgd door verwijdering van de aminegroep (deaminering) van deze verbinding. Deze techniek biedt de mogelijkheid om biomassa te gebruiken als grondstof voor nylon-6 in plaats van benzeen of fenol. Cellulose of zetmeel uit biomassa kan door hydrolyse worden omgezet in suikers, waarmee bepaalde bacteriën (meer bepaald Corynebacterium glutamicum) dan L-lysine kunnen produceren.[6]
Poly-L-lysine
Het peptide poly-lysine is een polymeer van verschillende lysines. Omdat de aminogroep een pKa van 10,2 heeft, is deze groep bij (neutrale) pH 7, positief geladen (-NH3+).
Met dit positief geladen polymeer kan DNA gebonden worden (bij de constructie van DNA-microarrays): Een glasoppervlak is bij neutrale (en basische) pH deels negatief geladen door SiO−-groepen. Zij kunnen elektrostatisch met polylysine binden, dat op zijn beurt dan weer de negatief geladen fosfaat-groepen van DNA bindt.
Referenties
|
| De 20 proteïnogene aminozuren |
|---|
|
Alanine (Ala) · Arginine (Arg) · Asparagine (Asn) · Asparaginezuur (Asp) · Cysteïne (Cys) · Glutamine (Gln) · Glutaminezuur (Glu) · Glycine (Gly) · Histidine (His) · Isoleucine (Ile) · Leucine (Leu) · Lysine (Lys) · Methionine (Met) · Fenylalanine (Phe) · Proline (Pro) · Serine (Ser) · Threonine (Thr) · Tryptofaan (Trp) · Tyrosine (Tyr) · Valine (Val) |