Serine
Serine (afgekort tot Ser of S) is een van de twintig natuurlijk voorkomende aminozuren. De stof komt voor als wit kristallijn poeder, dat goed oplosbaar is in water. De kristallen zijn naaldvormig en bezitten een zoete smaak.
L-serine
| ||||
| Structuurformule en molecuulmodel | ||||
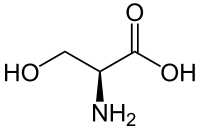 | ||||
Structuurformule van L-serine | ||||
 | ||||
Molecuulmodel van L-serine | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C3H7NO3 | |||
| IUPAC-naam | S-2-amino-3-hydroxypropaanzuur | |||
| Andere namen | β-hydroxyalanine | |||
| Molmassa | 105,09258 g/mol | |||
| SMILES | C(C(C(=O)O)N)O | |||
| InChI | 1S/C3H7NO3/c4-2(1-5)3(6)7/h2,5H,1,4H2,(H,6,7)/t2-/m0/s1 | |||
| CAS-nummer | 56-45-1 | |||
| EG-nummer | 200-274-3 | |||
| PubChem | 5951 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | (bij 20°C) 1,603 g/cm³ | |||
| Smeltpunt | 222 °C | |||
| Oplosbaarheid in water | 364 g/l | |||
| Goed oplosbaar in | water | |||
| Onoplosbaar in | ethanol, di-ethylether | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Serine wordt gecodeerd door de codons UCU, UCC, UCA, UCG, AGU en AGC.
Synthese
Op industriële schaal wordt serine bereid door vergisting. De jaarlijkse hoeveelheid die op deze manier wordt geproduceerd wordt geschat op 100 tot 1000 ton. In het laboratorium kan het als racemaat worden bereid uit methylacrylaat in verschillende stappen:[1]
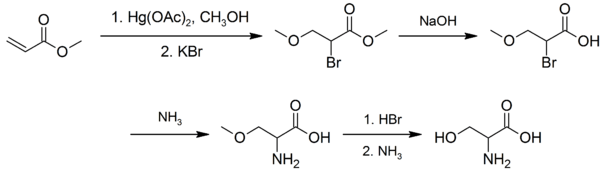 Synthese van serine
Synthese van serine
De eerste stap betreft een oxidatie met kwik(II)acetaat in methanol, gevolgd door behandeling met kaliumbromide. De hierdoor ontstane α-broomester wordt vervolgens verzeept met behulp van natriumhydroxide, waarna het bromide met ammoniak wordt omgezet in een amine. De hydrolyse van de methylether leidt vervolgens tot de vorming van serine.
Voorkomen, biosynthese en metabolisme
Serine is een niet-essentieel aminozuur, omdat het in het lichaam wordt gevormd uit andere metabolieten, zoals glycine. Het aminozuur werd voor het eerst geïsoleerd in 1865 uit proteïnen in zijde. De naam is afgeleid van het Latijnse woord voor zijde, namelijk sericum.
De biosynthese van serine start met de oxidatie van 3-fosfoglyceraat tot 3-fosfopyruvaat en NADH. De reductieve aminering van dit keton, gevolgd door hydrolyse, levert serine. Het enzym serine-hydroxymethyltransferase katalyseert de reversibele omzetting van L-serine naar glycine (via een retro-aldol-reactie).[2]
Structuur en eigenschappen
Het residu van serine is een alcoholfunctie die via een methyleengroep verbonden is met het centraal α-koolstofatoom. Serine wordt geclassificeerd als een hydrofiel aminozuur. Het is goed oplosbaar in water, maar niet in di-ethylether en ethanol.
De zuurconstanten van serine zijn:[3]
- pKa1 (carboxylgroep) = 2,21
- pKa2 (aminegroep) = 9,15
Het iso-elektrisch punt ligt bij pH 5,68.[3]
Door de aanwezigheid van een hydrofiele hydroxylgroep in het residu kan serine gefosforyleerd worden. In die context speelt het aminozuur een niet onbelangrijke rol bij de activering of inhibitie van enzymen. Wanneer serine addeert aan palmitaldehyde (het aldehyde van palmitinezuur) en dehydrogeneerd worden, dan vormt zich een sfingolipide.
Biologische functies
Serine is een belangrijke verbinding, omdat het deelneemt aan de biosynthese van purines en pyrimidines. Daarnaast is het een precursor voor de synthese van andere aminozuren, zoals glycine, cysteïne en tryptofaan. Zo start de biosynthese van cysteïne in dieren met serine en homocysteïne. Tevens is het aminozuur een precursor voor talloze andere metabolieten, waaronder sfingolipiden en foliumzuur.
Het aminozuur maakt deel uit van het katalytische centrum van verschillende enzymen, waaronder chymotrypsine en trypsine.
Bronnen, noten en/of referenties
|
| De 20 proteïnogene aminozuren |
|---|
|
Alanine (Ala) · Arginine (Arg) · Asparagine (Asn) · Asparaginezuur (Asp) · Cysteïne (Cys) · Glutamine (Gln) · Glutaminezuur (Glu) · Glycine (Gly) · Histidine (His) · Isoleucine (Ile) · Leucine (Leu) · Lysine (Lys) · Methionine (Met) · Fenylalanine (Phe) · Proline (Pro) · Serine (Ser) · Threonine (Thr) · Tryptofaan (Trp) · Tyrosine (Tyr) · Valine (Val) |