Oxidatie
Oxidatie is het chemische proces waarbij de geoxideerde stof, de reductor, elektronen afstaat aan een andere stof (de oxidator). Door oxidatie neemt het oxidatiegetal van de geoxideerde stof of reductor toe: een geoxideerde stof 'wil zijn afgestane elektronen terug'. Het oxidatiegetal van de (gereduceerde) oxidator neemt navenant af.
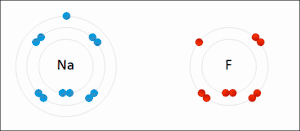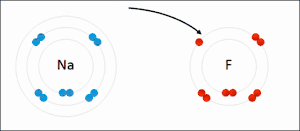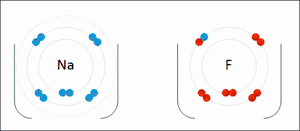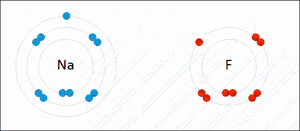
De term oxidatie is afgeleid van oxygenium (in Nederlandse leenvertaling zuurstof), beide termen een Frans, wetenschappelijk neologisme van de achttiende-eeuwse Franse scheikundige Lavoisier, ontleend aan het Oudgrieks. De oudst bekende, natuurlijke oxidatiereacties zijn dan ook alledaagse verschijnselen als verbranding en zuurstofcorrosie, waarbij zuurstof de valentie-elektronen afneemt van respectievelijk koolstof uit bijvoorbeeld koolwaterstoffen, hout (waarbij koolstofdioxide wordt gevormd), en van metalen als koper en ijzer (waarbij respectievelijk koperoxide en ijzeroxide (roest) worden gevormd). Oxidatie is echter breder dan chemische reacties met zuurstof. De naam 'oxidatie' wordt inmiddels bij uitbreiding gebruikt voor iedere willekeurige chemische reactie waarbij elektronenuitwisseling plaatsvindt. Een voorbeeld van oxidatie waarbij geen zuurstof aan te pas komt is die van tweewaardig (Fe2+) naar driewaardig ijzer (Fe3+):
Fe2+ is hier de reductor. Het staat één elektron af en wordt daarbij geoxideerd tot Fe3+.
Met een oxidatie gaat altijd een reductie gepaard. De afgestane elektronen moeten namelijk opgenomen worden door een andere stof (de oxidator), die dus gereduceerd wordt. De samengang van een oxidatie en een reductie wordt een oxidatie-reductiereactie of redoxreactie genoemd.
Roesten en corrosie

Met roesten wordt in het dagelijks taalgebruik de reactie van ijzer met zuurstof bedoeld. Roesten is een vorm van corrosie: de oxidatie van een metalen voorwerp dat daardoor minder bruikbaar wordt.
(roesten/corrosie) (corrosie)
Oxidatie in de organische chemie
In de organische chemie levert de stapsgewijze oxidatie van een koolwaterstof water op en achtereenvolgens een alcohol, een aldehyde of keton, een carbonzuur en ten slotte een peroxycarbonzuur (perzuur). Deze stappen kunnen soms niet allemaal doorgaan. Dit verschil is te wijten aan het aantal waterstofatomen aan het koolstofatoom dat onmiddellijk aan de hydroxylgroep gebonden is. Verder speelt ook het type oxidator een belangrijke rol: sommige oxidatoren zijn zeer krachtig en laten directe oxidatie tot het carbonzuur toe (zoals het Jones-reagens), terwijl andere enkel oxidatie tot het aldehyde of keton toelaten (zoals Dess-Martin-perjodinaan).
Een primair alcohol zal via een aldehyde uiteindelijk naar een carbonzuur en zelfs een peroxycarbonzuur gaan. Een secundair alcohol zal uiteindelijk een keton vormen. Een tertiair alcohol zal meestal niet reageren. Onder bepaalde omstandigheden kan een organisch peroxide gevormd worden, of kan een omlegging van het koolstofskelet bekomen worden (bijvoorbeeld de Babler-oxidatie).
Biochemie
Oxidatie speelt ook in de biochemie een belangrijke rol. Alle aerobe organismen hebben zuurstof nodig voor hun stofwisseling, met name voor de celademhaling: de biologische 'verbranding' van het koolstofhoudende glucose in de cellen, waarbij ATP gegenereerd wordt. Bij de verbranding wordt glucose geoxideerd tot koolstofdioxide en water. Bij de fotosynthese, het proces dat in wezen omgekeerd is aan de celademhaling, wordt het koolstofdioxide uit de lucht gereduceerd tot koolhydraten (tijdens donkerreacties) en water geoxideerd tot moleculair zuurstof (tijdens lichtreacties).
Inklinking van veen
Het inklinken van veen is het gevolg van biologische afbraak door aerobe bacteriën. Deze bacteriën oxideren (ook weer via celademhaling) de, in drooggevallen, zuurstofrijk organisch veenmateriaal aanwezige, koolstof voor hun energievoorziening, waarbij koolstofdioxide vrijkomt.
Zie ook
- Reductie (scheikunde)
- Verbranding
- Veenoxidatie
| Zoek oxidatie op in het WikiWoordenboek. |
| Zie de categorie Oxidations van Wikimedia Commons voor mediabestanden over dit onderwerp. |