Tetrachloormethaan
Tetrachloormethaan, tetrachloorkoolstof of koolstoftetrachloride, kortweg tetra genoemd, is een organische verbinding van koolstof en chloor, met als brutoformule CCl4. Tetrachloormethaan wordt ook wel vlekkenwater genoemd. Vlekkenwater is eigenlijk een onjuiste benaming, aangezien er geen water in voorkomt. Water en tetrachloormethaan mengen namelijk niet: water is polair en tetrachloormethaan apolair. Tetrachloormethaan werd dan ook veel gebruikt als apolair oplosmiddel in de chemie. Tegenwoordig is het vanwege zijn carcinogene eigenschappen niet meer toegestaan tetrachloormethaan in open reactievaten te gebruiken, terwijl ook het gebruik in gesloten opstellingen aan strenge regels onderworpen is.
Tetrachloormethaan
| ||||
| Structuurformule en molecuulmodel | ||||
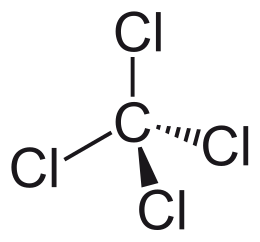 | ||||
Structuurformule van Tetrachloormethaan | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | CCl4 | |||
| IUPAC-naam | tetrachloormethaan | |||
| Andere namen | tetra, benziform, methaantetrachloride, perchloormethaan, CTC (koolstoftetrachloor) | |||
| Molmassa | 153,8 g/mol | |||
| SMILES | ClC(Cl)(Cl)Cl | |||
| CAS-nummer | 56-23-5 | |||
| EG-nummer | 200-262-8 | |||
| Beschrijving | Kleurloze zoetig ruikende vloeistof | |||
| Vergelijkbaar met | tetrafluormethaan, chloroform | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H301 - H311 - H331 - H351 - H372 - H412 | |||
| EUH-zinnen | EUH059 | |||
| P-zinnen | P273 - P281-P314-P501 | |||
| MAC-waarde | 65 mg/m³ | |||
| Fysische eigenschappen | ||||
| Dichtheid | 1,5842 g/cm³ | |||
| Smeltpunt | −23 °C | |||
| Kookpunt | 77 °C | |||
| Goed oplosbaar in | apolaire oplosmiddelen | |||
| Slecht oplosbaar in | water | |||
| Brekingsindex | 1,466 (589 nm, 20 °C) | |||
| Geometrie en kristalstructuur | ||||
| Dipoolmoment | 0 D | |||
| Thermodynamische eigenschappen | ||||
| ΔfH | −128 kJ/mol | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Tetrachloormethaan wordt industrieel geproduceerd door methaan met chloorgas te laten reageren bij 400-500°C. Dit proces verloopt in enkele radicalaire reactiestappen:
Het resultaat van deze processen is een mengsel van chloormethaan, dichloormethaan, chloroform en tetrachloormethaan. Dat mengsel wordt gescheiden door middel van destillatie.
Alternatieve en vroeger toegepaste methoden betreffen onder andere de chlorinolyse. Hierbij wordt hexachloorethaan behandeld met een overmaat chloorgas, waarbij de sterke koolstof-koolstofbinding breekt en 2 moleculen tetrachloormethaan worden gevormd:
In de eerste helft van de 20e eeuw werd de stof bereid door reactie van koolstofdisulfide en dichloor bij 105 tot 130°C:
Eigenschappen en toepassingen
De werking van tetrachloormethaan berust op het apolaire karakter van de stof. Hoewel de binding tussen koolstof en chloor polair is, heeft de tetraëdrische constructie van de stof tot gevolg dat de molecule symmetrisch is en dus geen netto dipoolmoment bezit. Doordat tetrachloormethaan apolair is, kan het goed vetten oplossen. Het lost ook elementair zwavel en jood vrij goed op.
Toxicologie en veiligheid
Tetrachloormethaan is bij inademing en bij inname giftig.
Externe links
| Halomethanen | ||||||||
|---|---|---|---|---|---|---|---|---|
|

