Chloorjoodmethaan
Chloorjoodmethaan is een halomethaan van chloor en jood, met als brutoformule CH2ClI. De stof komt voor als een kleurloze, lichtgele tot rood-paarse vloeistof, die zeer goed oplosbaar is in aceton, benzeen, di-ethylether en ethanol.
Chloorjoodmethaan
| ||||
| Structuurformule en molecuulmodel | ||||
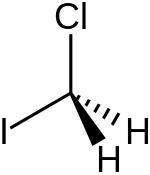 | ||||
Structuurformule van chloorjoodmethaan | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | CH2ClI | |||
| IUPAC-naam | chloorjoodmethaan | |||
| Molmassa | 176,38405 g/mol | |||
| SMILES | C(Cl)I | |||
| InChI | 1S/CH2ClI/c2-1-3/h1H2 | |||
| CAS-nummer | 593-71-5 | |||
| EG-nummer | 209-804-8 | |||
| PubChem | 11644 | |||
| Beschrijving | Kleurloze, lichtgele tot rood-paarse vloeistof | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H315 - H319 - H335 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P261 - P305+P351+P338 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos-lichtgeel-rood-paars | |||
| Dichtheid | 2,422 g/cm³ | |||
| Kookpunt | 108 - 109 °C | |||
| Goed oplosbaar in | aceton, benzeen, di-ethylether, ethanol | |||
| Brekingsindex | 1,5812 - 1,5832 (589 nm, 20 °C) | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Chloorjoodmethaan kan bereid worden uit reactie van dichloormethaan en natriumjodide in DMF.[1]
Kristalstructuur
Chloorjoodmethaan kan, bij voldoende lage temperatuur, als vaste stof uitkristalliseren. Het neemt een orthorombische kristalstructuur aan en behoort tot ruimtegroep Pnma. De parameters van de eenheidscel bedragen:
- a = 6,383 Å
- b = 6,706 Å
- c = 8,867 Å
Toepassingen
Chloorjoodmethaan kent een aantal toepassingen in de organische synthese, waaronder bij de Simmon-Smith-reactie, de Mannich-reactie, aminomethylering, epoxidatie, ringopeningsreacties en bij additiereacties aan terminale alkenen. Het vervangt meestal di-joodmethaan, omdat het selectiever werkt en een hogere opbrengst geeft.
Externe links
- (en) MSDS van chloorjoodmethaan
- (en) Gedetailleerd overzicht van het gebruik van chloorjoodmethaan in de organische chemie
| Halomethanen | ||||||||
|---|---|---|---|---|---|---|---|---|
|
Bronnen, noten en/of referenties
|
