Trichloorfluormethaan
Trichloorfluormethaan, ook bekend onder de namen freon-11, CFC-11, of R-11, is een chloorfluorkoolstofverbinding. De kleurloze en vrijwel reukloze vloeistof heeft een kookpunt rond kamertemperatuur.
Trichloorfluormethaan
| ||||
| Structuurformule en molecuulmodel | ||||
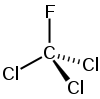 | ||||
Structuurformule van trichloorfluormethaan | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | CCl3F | |||
| IUPAC-naam | trichloorfluormethaan | |||
| Andere namen | fluortrichloormethaan, fluorchloroform, Freon 11, CFC 11, R 11, Arcton 9, Freon 11A, Freon 11B, Freon HE, Freon MF | |||
| Molmassa | 137,37 g/mol | |||
| SMILES | C(F)(Cl)(Cl)Cl | |||
| InChI | 1/CCl3F/c2-1(3,4)5 | |||
| CAS-nummer | 75-69-4 | |||
| EG-nummer | 200-892-3 | |||
| PubChem | 6389 | |||
| Beschrijving | Kleurloze vloeistof of gas | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H312 - H420 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P273 - P280 - P501 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | gasvormig | |||
| Kleur | kleurloos | |||
| Dichtheid | 1,494 g/cm³ | |||
| Smeltpunt | −110,48 °C | |||
| Kookpunt | 23,77 °C | |||
| Dampdruk | (20 °C) 89 kPa, (30 °C) 131 Pa | |||
| Oplosbaarheid in water | (20 °C) 1,1 g/l | |||
| Slecht oplosbaar in | water | |||
| Brekingsindex | 1,3821 (589 nm, 20 °C) | |||
| Geometrie en kristalstructuur | ||||
| Dipoolmoment | 0,450 D | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Toepassingen
Trichloorfluormethaan is in het verleden vooral toegepast als koudemiddel. Het grote voordeel van de verbinding bij zijn introductie werd gevormd door het hoge kookpunt, in vergelijking met toen gangbare stoffen als ammoniak, R-12 of R-22. Het hoge kookpunt betekent een veel lagere druk in het koelsysteem waardoor de technische eisen (sterkte) aan buizen en dergelijke veel lager kunnen zijn.
Vanwege het hoge chloorgehalte in het molecule én het gemak waarmee de chlooratomen uit het molecule loskomen onder invloed van UV-licht, heeft R-11 een van de hoogste ozonafbrekende vermogens van alle koelmiddelen. De waarde ervan is per definitie op 1,0 gesteld. In de Verenigde Staten is de productie in 1995 gestopt. Verder is het een belangrijk broeikasgas.
Trichloorfluormethaan wordt gebruikt als referentiestof in fluor-19 NMR studies.
Gat in de ozonlaag
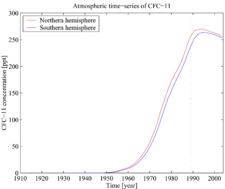
Trichloorfluormethaan (CFC-11) bleek - eind jaren '90 (20e eeuw) - de ozonlaag af te breken. Er kwamen milieuacties op gang die het publiek bewust moesten maken van dit grote nadeel. Zo gingen steeds meer landen er uiteindelijk toe over de productie te staken. In 2010 spraken landen middels het Protocol van Montreal af de productie helemaal te staken. Via metingen kon worden vastgesteld dat de concentratie CFC-11 in de atmosfeer gestaag afnam en dat het gat in de ozonlaag kleiner werd.
Vanaf 2012 merkten onderzoekers dat deze afname afnam. De conclusie van metingen in Azië was dat in China grote hoeveelheden van het gas vrijkomen (wel zo'n 7 miljoen kilo p.j.).[1]
Tabel van een aantal fysische eigenschappen van trichloorfluormethaan
| Eigenschap | Waarde |
|---|---|
| Dichtheid (ρ) bij 0 °C | 1,5432 g·cm−3 |
| Dichtheid (ρ) bij 18,82 °C | 1,4905 g·cm−3 |
| Kritische temperatuur (Tc) | 198 °C (471 K) |
| Kritische druk (pc) | 4,410 MPa (44,1 bar) |
| Kritische dichtheid (ρc) | 4,151 mol·L−1 |
| Brekingsindex (n) 20 °C, D | 1,3821 |
| Acentrische factor (ω) | 0,18875 |
| Ozone depletion potential (ODP) | 1 (per definitie) |
| Aardopwarmingsvermogen | 4600 (CO2 = 1) |
Externe links
Referenties
| Halomethanen | ||||||||
|---|---|---|---|---|---|---|---|---|
|
