Fluoroform
Fluoroform of trifluormethaan is een halomethaan van fluor met als brutoformule CHF3. Het is een reukloos en kleurloos gas, dat onoplosbaar is in water. Fluoroform is een bijproduct in de synthese van teflon.
Fluoroform
| ||||
| Structuurformule en molecuulmodel | ||||
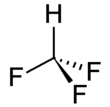 | ||||
Structuurformule van fluoroform | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | CHF3 | |||
| IUPAC-naam | trifluormethaan | |||
| Andere namen | methyltrifluoride, Freon 23, Arcton 1, HFC 23, R-23, FE-13 | |||
| Molmassa | 70,01385 g/mol | |||
| SMILES | C(F)(F)F | |||
| InChI | 1S/CHF3/c2-1(3)4/h1H | |||
| CAS-nummer | 75-46-7 | |||
| EG-nummer | 200-872-4 | |||
| PubChem | 6373 | |||
| Beschrijving | Reukloos en kleurloos gas | |||
| Vergelijkbaar met | chloroform | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H280 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P410+P403 | |||
| Opslag | Koel opslaan. Verluchting langs de vloer. | |||
| VN-nummer | 1984 | |||
| ADR-klasse | Gevarenklasse 2.2 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | gasvormig | |||
| Kleur | kleurloos | |||
| Dichtheid | 1,44 g/cm³ | |||
| Smeltpunt | −155 °C | |||
| Kookpunt | −84,4 °C | |||
| Dampdruk | (bij 20°C) 4.380.000 Pa | |||
| Oplosbaarheid in water | 1 g/l | |||
| Matig oplosbaar in | organische oplosmiddelen | |||
| Onoplosbaar in | water | |||
| log(Pow) | 0,64 | |||
| Evenwichtsconstante(n) | pKa = 25 - 28 | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Fluoroform werd voor het eerst bereid door Maurice Meslans in 1894 door middel van een reactie van jodoform en zilver(II)fluoride.[1] Aangezien deze reactie bijzonder hevig en exotherm was, werd ze verbeterd door Otto Ruff. Hij verving zilver(II)fluoride door een mengsel van kwik(II)fluoride en calciumfluoride.[2] Deze reactie werd nog verder aangepast tot een tweestapsproces, dat beschouwd wordt als de meest efficiënte methode om fluoroform te synthetiseren. Eerst wordt er broomdifluormethaan gevormd uit een reactie van antimoon(III)fluoride en bromoform. Als tweede stap laat men het gevormde broomdifluormethaan reageren met kwik(II)fluoride.
Toepassingen
Fluoroform wordt in de halfgeleider-industrie gebruikt voor het plasma-etsen van siliciumoxide en siliciumnitride. Het is tevens een koelmiddel, ook bekend onder de naam Freon 23 en HFC-23. In deze context wordt het soms ter vervanging van chloortrifluormethaan gebruikt.
Fluoroform wordt, omwille van de lage toxiciteit, lage reactiviteit en hoge dichtheid, gebruikt als vuurdovend middel.
In de organische chemie is fluoroform door deprotonering een bron van CF3−-ionen. Deze groep, de trifluormethylgroep, is een regelmatig voorkomende functionele groep in de organische chemie.
Broeikasgas
Fluoroform is een mogelijk broeikasgas, waarvan geschat wordt dat één ton in de atmosfeer gelijkstaat aan 11.700 ton koolstofdioxide. De atmosferische leeftijd van de stof is 260 jaar.
Toxicologie en veiligheid
Bij contact met een heet oppervlak of met een vlam ontleedt deze stof, met vorming van corrosieve en zeer giftige dampen van onder andere waterstoffluoride.
Inademing van de damp kan verminderde activiteit van het centraal zenuwstelsel veroorzaken en leiden tot slaperigheid en bewusteloosheid. Als het gas vloeibaar wordt gemaakt (temperaturen lager dan −85 °C), dan kan dit bevriezing veroorzaken. Blootstelling zou een onregelmatig hartritme en verstikking kunnen veroorzaken.
Externe link
Bronnen, noten en/of referenties
|
| Halomethanen | ||||||||
|---|---|---|---|---|---|---|---|---|
|
