Methaan
Methaan (CH4) is de eenvoudigste koolwaterstof en behoort tot de groep der alkanen. Het bezit een tetraëdrische moleculaire geometrie. Het centrale sp3-gehybridiseerde koolstofatoom is volledig verzadigd. Methaan is bij kamertemperatuur en bij atmosferische druk een gas. Het werd in 1778 ontdekt door Alessandro Volta.
Methaan
| ||||
| Structuurformule en molecuulmodel | ||||
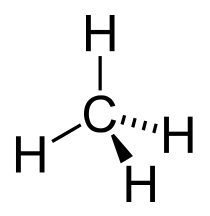 | ||||
Structuurformule van methaan | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | CH4 | |||
| IUPAC-naam | methaan | |||
| Andere namen | moerasgas, grauwvuurgas, mijngas | |||
| Molmassa | 16,04 g/mol | |||
| SMILES | C | |||
| CAS-nummer | 74-82-8 | |||
| Beschrijving | Brandbaar gas | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H220 - H280[1] | |||
| EUH-zinnen | geen | |||
| P-zinnen | P210 - P410+P403[1] | |||
| Omgang | Verwijderd houden van hitte, vonken en open vuur | |||
| Opslag | Brandveilig en koel bewaren. Verluchting langs de vloer en het plafond. | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | gasvormig | |||
| Kleur | kleurloos | |||
| Dichtheid | (gas, 25 °C, 1 atm) 0,656 × 10−3 g/cm³ (gas, 0 °C, 1 atm) 0,716 × 10−3 g/cm³ | |||
| Smeltpunt | −182,48 °C | |||
| Kookpunt | −164 °C | |||
| Vlampunt | −188 °C | |||
| Zelfontbrandings- temperatuur | 537 °C | |||
| Oplosbaarheid in water | (bij 20°C) 0,0227 g/l | |||
| Thermodynamische eigenschappen | ||||
| ΔfH | −74,81 kJ/mol | |||
| S | 83,7 J/mol·K | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Methaan, ook bekend onder de naam moerasgas, is het voornaamste bestanddeel van aardgas. Aardgas wordt in de natuur aangetroffen in samenhang met aardolie en andere fossiele brandstoffen, en heeft een vergelijkbare geologische oorsprong, ontstaan uit vergane resten organisch materiaal.
Ontstaan en bronnen
Methaan kan ontstaan uit verschillende natuurlijke processen (aardkorst, zeebodem, draslanden en venen) of uit antropogene bronnen (fossiele industrie, bio-industrie, vuilnisbelten). Hoewel vrij nauwkeurig kan gemeten worden hoeveel methaan jaarlijks wordt uitgestoten, is het veel moeilijker precies na te gaan welke de bronnen zijn.[2]
Geologische bronnen
De twee belangrijkste routes voor geologische methaanproductie zijn:
- organisch (thermisch gegenereerd, of thermogeen) . Thermogeen methaan komt voor door het uiteenvallen van organische materie bij hoge temperaturen en hoge druk in diepe sedimentaire lagen. Het meeste methaan in sedimentatiebekkens is thermogeen; daarom is thermogeen methaan de belangrijkste bron van aardgas.
- anorganisch of abiotisch, dit betekent dat methaan wordt gevormd uit anorganische verbindingen, zonder biologische activiteit, hetzij door magmatische processen of via water-rots-reacties die optreden bij lage temperaturen en drukken, zoals bij de vorming van serpentiniet.
Biologische bronnen
Methaan ontstaat onder andere bij afbraak van organische stoffen door bacteriën onder anaerobe (zuurstofloze) omstandigheden. Anaerobe omstandigheden komen veelal in moerasbodems voor. Ook in zuurstofarme grond wordt onder andere door de afbraak van dode plantenwortels methaan gevormd. Ook bij bosbranden kan methaan ontstaan door verhitting van organische stof.
Veeteelt
Herkauwers, maar vooral runderen, leveren met hun boeren en winden een grote bijdrage aan de wereldwijde uitstoot van methaangassen. Juist een hoog aandeel ruwvoer zorgt voor deze methaanproductie in de pens door middel van fermentatie door de bacteriën. De veeteelt zou zelfs bijna 40% van de menselijke uitstoot van methaan vertegenwoordigen.[3] Mits aanpassingen van de samenstelling van krachtvoer zijn er mogelijkheden om dit te verminderen, alsmede met uitgekiend graslandbeheer.[4][5] Ook het gericht kruisen van rassen zou helpen.[3] In de omgeving van rundveehouderijen is dan ook een verhoogde concentratie van methaan aanwezig. Er zijn gevallen bekend waarin stallen in brand vlogen door een verhoogde concentratie methaan.[6]
Zeebodem
Het grootste deel van de diepere zeebodem is anoxisch omdat zuurstof wordt onttrokken door aërobe micro-organismen in de bovenste paar centimeters van het sediment. In de zeebodem produceren methanogenen methaan dat door andere organismen wordt gebruikt, of in gashydraten wordt opgesloten. Deze andere organismen die methaan voor energie gebruiken, staan bekend als methanotrofen (methaaneters), en zijn de belangrijkste reden waarom weinig methaan uit de zeebodem het zeeoppervlak bereikt.
Industriële bronnen
Methaanproductie
Methaan wordt geproduceerd door hydrogenering van kooldioxide in een Sabatierreactie. Methaan is ook een bijproduct van de hydrogenering van koolmonoxide in het Fischer-Tropsch proces. Voor praktische toepassingen wordt methaangas ook verkocht in stalen cilinders. (overnemen tekst Uit anaerobe vergisting van biologische afvalstoffen wordt methaan gewonnen voor productie van groene stroom of warmtekrachtkoppeling.
Fossiele energiebedrijven
Bij de productie, verwerking en transport van fossiele energiebronnen (olie, aardgas, steenkool) komt methaangas vrij. En bij de fracking van schaliegas en schalieolie zou de uitstoot nog groter zijn.[7] Het aandeel van de fossiele industrie in de methaanuitstoot zou volgens onderzoek uit 2020 in het verleden sterk onderschat zijn geweest.[8]
Chemie
Moleculaire structuur
Een methaanmolecule bestaat uit een centraal koolstofatoom met daarom vier waterstofatomen, gerangschikt volgens een symmetrische tetraëder. Deze symmetrie bepaalt in belangrijke mate de eigenschappen van methaan. Zo leidt de symmetrie ertoe dat methaan strikt apolair is, waardoor het gasvormig en weinig reactief is onder standaard omstandigheden.
Deze symmetrie kan theoretisch worden voorspeld met MO-theorie, en is ook experimenteel aangetoond met onder andere röntgendiffractie en UV/VIS-spectroscopie. Deze ontdekkingen hebben geleid tot de vorming van het hybridisatiemodel. Het koolstofatoom in methaan is sp3-gehybridiseerd. Dientengevolge zijn de koolstof-waterstofbindingen in methaan zeer sterk en verloopt bijvoorbeeld de deprotonering bijzonder moeizaam (de pKa van methaan ligt namelijk boven de 50).
Reacties
Methaan is net als alle alkanen weinig reactief. Eigenlijk reageert het alleen met sterke oxidatoren zoals zuurstof(verbranding) of de halogenen. Een andere belangrijke reactie is stoomreforming.
Verbrandingsreacties
De verbranding is als volgt:[9] (vormingsenthalpie ΔfHo = −891 kJ · mol−1)
Als er niet genoeg zuurstof is, zal de verbranding onvolledig zijn en ontstaat ook koolstofmonoxide (CO):
Of ook cokes:
Chloormethaanproductie
Chloormethanen worden gemaakt door radicalaire reactie met chloorgas:[10]
Stoomreforming
Methaan bevat de hoogste H/C verhouding van alle koolwaterstoffen, en daarom wordt methaan vaak gebruikt om waterstof te produceren. Hierbij worden methaan (doorgaans aardgas) en stoom onder verhoogde druk en temperatuur over een metalen katalysator geleid:
Deze reactie wordt vooral toegepast in het Haber-Boschproces, waarbij grote hoeveelheden waterstof nodig zijn voor de productie van ammoniak, en bij vergassing van biomassa om synthesegas te produceren.
Synthese
Methaan kan worden gevormd uit gemakkelijk afbreekbare organische stoffen, zoals azijnzuur:
Natriumacetaat kan ook samen met natriumhydroxide methaan vormen:
Methaan kan ook uit koolstofdioxide en waterstofgas gevormd worden volgens een langzaam verlopende reactie:
Methaanhydraat
Sedimenten op de oceaanbodems en in permafrostgebieden aan de onderzijde van de bevroren bodemlaag bevatten heel grote methaanvoorraden: methaan dat onder hoge druk een clatraat of insluitverbinding vormt met water (ijs), methaanhydraat of methaanijs, waarin methaan als gashydraat in vaste vorm aanwezig is. Soms ontsnapt een deel van dit methaan in gasvorm naar de oppervlakte. De methaanclatraten zouden, vanwege de grote omvang van de voorraden, potentieel een belangrijke energiebron kunnen vormen, maar de winning ervan op de bodem van de oceaan is met de huidige stand der techniek nog zeer moeilijk.
Schadelijkheid
Methaan is schadelijk voor het klimaat, omdat het bijdraagt aan het versterkte broeikaseffect. Het is als broeikasgas ongeveer 25 keer zo sterk als koolstofdioxide.[11] Sinds 1750 is de hoeveelheid methaan in de lucht meer dan verdubbeld. De levensduur van methaan in de atmosfeer is om en nabij de tien jaar.
Er wordt gevreesd dat stijging van de temperatuur op aarde zal leiden tot het ontdooien van de permafrost. Dit zou kunnen leiden tot het vrijkomen van grote hoeveelheden methaan en een verdere toename van het broeikaseffect.
Zie ook
Externe links

- (en) Gegevens van Methaan in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
- (en) MSDS van methaan
- Methaangas op Mars (Kennislink-artikel)
- (en) Bonding in methane
Bronnen, noten en/of referenties
|
| Zie de categorie Methane van Wikimedia Commons voor mediabestanden over dit onderwerp. |
| Lineaire alkanen |
|---|
|
Methaan · Ethaan · Propaan · Butaan · Pentaan · Hexaan · Heptaan · Octaan · Nonaan · Decaan · Undecaan · Dodecaan · Tridecaan · Tetradecaan · Pentadecaan · Hexadecaan · Heptadecaan · Octadecaan · Nonadecaan · Eicosaan · Tetracosaan · Pentacosaan · Nonacosaan · Hentriacontaan |

