Hexachloorethaan
Hexachloorethaan of perchloorethaan is een organische verbinding, met als brutoformule C2Cl6. Het is bij kamertemperatuur een kleurloos tot wit poeder met een kamferachtige geur. De stof sublimeert bij een temperatuur van 183-185°C.
Hexachloorethaan
| |||||
| Structuurformule en molecuulmodel | |||||
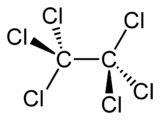 | |||||
Structuurformule van hexachloorethaan | |||||
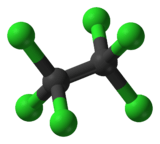 | |||||
Molecuulmodel van hexachloorethaan | |||||
| Algemeen | |||||
| Molecuulformule (uitleg) | C2Cl6 | ||||
| IUPAC-naam | hexachloorethaan | ||||
| Andere namen | perchloorethaan, R-116, CFC-116 | ||||
| Molmassa | 236,74 g/mol | ||||
| CAS-nummer | 67-72-1 | ||||
| EG-nummer | 200-666-4 | ||||
| Beschrijving | Kleurloos tot wit poeder | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H315 - H319 - H335 - H351 - H410 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P261 - P273 - P281 - P305+P351+P338 - P501 | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | kleurloos-wit | ||||
| Dichtheid | 2,1 g/cm³ | ||||
| Dampdruk | 53 Pa | ||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Synthese
Hexachloorethaan wordt bereid door het chloreren van tetrachlooretheen.
Toepassingen
Hexachloorethaan wordt over de hele wereld gebruikt in aluminiumhoogovens om waterstofgas te verwijderen. Dat gas lost goed op in gesmolten aluminiumlegeringen waardoor er bij het stollen gasbelletjes kunnen ontstaan. De smelt moet daarom ontgast worden. Chloor (afkomstig van de thermische ontbinding van hexachloorethaan) is daarvoor geschikt. Door de mechanische actie van het omwoelen van het smeltbad ontsnapt de waterstof, en chloor reageert ook met onzuiverheden zoals magnesium, natrium of calcium tot de overeenkomstige chloriden, die een drijflaag boven het smeltbad vormen en afgescheiden kunnen worden. Chloor reageert ook met aluminium tot gasvormig aluminiumchloride dat uit het smeltbad vrijkomt en in contact met de luchtvochtigheid giftige HCl-dampen vormt. Het vaste hexachloorethaan is veel gemakkelijker en veiliger op te slaan en te transporteren dan het zeer toxische en corrosieve chloorgas.[1][2]
Hexachloorethaan heeft ook een militaire en pyrotechnische toepassing, namelijk voor het produceren van rookgordijnen en in rookbommen of rookgranaten. Die bevatten een mengsel van hexachloorethaan en een metaalpoeder (meestal zink of zinkoxide). Als dat mengsel ontstoken wordt, vormt zich een dichte mist van sterk hygroscopische zinkchloridedeeltjes.[3]
Tevens doet hexachloorethaan dienst bij de synthese van perchloorethyleen.
Regelgeving
Omdat het een milieuverontreinigende stof is, is hexachloorethaan in de non-ferrometaalindustrie in de Europese Unie echter niet meer toegestaan sedert het begin van de 21e eeuw.[4][5]
Toxicologie en veiligheid
Uit hexachloorethaan kunnen carcinogene, toxische en bioaccumuleerbare stoffen ontstaan, zoals dioxinen, hexachloorbenzeen en chloorfenolen.
Hexachloorethaan ontleedt bij verbranding of verhitting boven 300°C, met vorming van giftige en corrosieve dampen, fosgeen en waterstofchloride. Ze reageert hevig met zink, aluminiumpoeder en natrium. Hexachloorethaan tast ook ijzer in aanwezigheid van vocht (water) aan, en moet daarom altijd worden opgeslagen in kunststoffen vaten.


