Broommethaan
Broommethaan of methylbromide (CH3Br), is een kleurloos, bijna reukloos en giftig gas. Het werd in het verleden vooral gebruikt voor begassing in de landbouw om de bodem te steriliseren en om ratten, insecten en schimmels te verdelgen (onder andere in zeecontainers). Het proces stond bekend onder de naam bromeren.
Broommethaan
| ||||||
| Structuurformule en molecuulmodel | ||||||
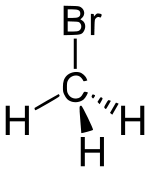 | ||||||
Structuurformule van broommethaan | ||||||
| Algemeen | ||||||
| Molecuulformule (uitleg) | CH3Br | |||||
| IUPAC-naam | broommethaan | |||||
| Andere namen | methylbromide | |||||
| Molmassa | 94,9 g/mol | |||||
| SMILES | CBr | |||||
| CAS-nummer | 74-83-9 | |||||
| EG-nummer | 200-813-2 | |||||
| Beschrijving | Kleurloos gas | |||||
| Waarschuwingen en veiligheidsmaatregelen | ||||||
| ||||||
| H-zinnen | H301 - H315 - H319 - H331 - H335 - H341 - H373 - H400 | |||||
| EUH-zinnen | geen | |||||
| P-zinnen | P261 - P273 - P281 - P301+P310 - P305+P351+P338 - P311 | |||||
| Opslag | Stevig gesloten houden verwijderd van hitte, vonken en open vlammen; omgevingstemperatuur gasfles niet boven 52°C uit laten komen | |||||
| VN-nummer | 1062 | |||||
| LD50 (ratten) | (oraal) 214 mg/kg | |||||
| Fysische eigenschappen | ||||||
| Aggregatietoestand | gas | |||||
| Kleur | kleurloos | |||||
| Dichtheid | 3,3 g/cm³ | |||||
| Smeltpunt | −93,6 °C | |||||
| Kookpunt | 3,56 °C | |||||
| Zelfontbrandings- temperatuur | 536 °C | |||||
| Dampdruk | 1,9 × 105 Pa | |||||
| Goed oplosbaar in | water | |||||
| Slecht oplosbaar in | di-ethylether | |||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||||
| ||||||
Het wordt ook gebruikt in de productie van andere chemische stoffen. Broommethaan is een ideaal substraat voor SN2-reacties.
Synthese
Methylbromide wordt bereid door de reactie van methanol met waterstofbromide of zwavelbromide.
Broommethaan en milieu
Methylbromide is een stof die de ozonlaag aantast, en het gebruik ervan is sedert 1 januari 2005 door het Montreal Protocol verboden. Vanaf 1 januari 2015 zou de productie ervan ook moeten stoppen. Als alternatief bij bodemontsmetting wordt onder andere 1,3-dichloorpropeen gebruikt, dat echter in de Europese Unie inmiddels eveneens verboden is (per 20 maart 2008).
De aanwezigheid van methylbromide in het milieu is in grote mate het gevolg van het gebruik als gassingsmiddel, maar het wordt ook gevormd in de oceanen, wellicht door algen en zeewieren. Het ontbindt langzaam in water tot methanol en waterstofbromide. In de lucht ontbindt het langzaam door fotolyse.
Toxicologie en veiligheid
Kortstondige inademing van methylbromide kan aanleiding geven tot duizeligheid, hoofdpijn, misselijkheid, maagkrampen en braken. Het irriteert en veroorzaakt pijn aan de ogen. Reeds bij lage concentraties (afhankelijk van de blootstellingsduur, 1600 tot 60.000 ppm) kan het dodelijk zijn. Contact met de huid veroorzaakt irritatie en jeuk, gevolgd door blaarvorming en pijn.
De grenswaarde voor beroepsmatige blootstelling is in België vastgesteld op 2 ppm (9 mg/m3) (tijdgewogen gemiddelde voor een referentieduur van 8 uur).
In Nederland is de grenswaarde vastgelegd op 0.25 PPM TGG-8uur.
Zie ook
Externe link
| Halomethanen | ||||||||
|---|---|---|---|---|---|---|---|---|
|



