Tetrabroommethaan
Tetrabroommethaan of koolstoftetrabromide (CBr4) is een gebromeerde verbinding die bestaat uit een centraal koolstofatoom met daaromheen vier broomatomen. Beide benamingen zijn correct volgens de IUPAC-nomenclatuur, omdat men de stof zowel kan beschouwen als een organische verbinding (tetrabroommethaan: volledig gebromeerd methaan) of als een anorganische verbinding (koolstoftetrabromide).
Tetrabroommethaan
| ||||
| Structuurformule en molecuulmodel | ||||
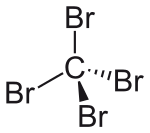 | ||||
Structuurformule van tetrabroommethaan | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | CBr4 | |||
| IUPAC-naam | tetrabroommethaan | |||
| Andere namen | koolstoftetrabromide, tetrabroomkoolstof | |||
| Molmassa | 331,6 g/mol | |||
| CAS-nummer | 558-13-4 | |||
| EG-nummer | 209-189-6 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H302 - H315 - H318 - H335 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P261 - P280 - P305+P351+P338 | |||
| VN-nummer | 2516 | |||
| ADR-klasse | Gevarenklasse 6.1 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | kleurloos | |||
| Dichtheid | 3,42 g/cm³ | |||
| Smeltpunt | 90 °C | |||
| Kookpunt | 190 °C | |||
| Onoplosbaar in | water | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Tetrabroommethaan is een kleurloze, kristallijne vaste stof. Er zijn twee kristalstructuren: de β-structuur komt voor beneden 46,9°C en de α-structuur boven 46,9°C. De stof is vrijwel onoplosbaar in water, maar goed oplosbaar in apolaire organische oplosmiddelen zoals tolueen of chloroform.
Synthese
Tetrabroommethaan kan bereid worden door de reactie van dibroom met methaan. Een andere mogelijkheid is de chlooratomen van tetrachloormethaan te vervangen door broomatomen, via de reactie van tetrachloormethaan met aluminiumbromide bij 100°C.
Toepassingen
Tetrabroommethaan is weinig stabiel in vergelijking met tetrachloormethaan, en geeft gemakkelijk een broomatoom af. Dit heeft te maken met het feit dat koolstof een zeer klein element is in vergelijking met broom, waardoor de bindingen tussen koolstof en broom relatief zwak zijn. Daarom kan het gebruikt worden als bromeringsmiddel.
Tetrabroommethaan wordt, samen met trifenylfosfine, gebruikt in de Appel-reactie om een alcohol om te zetten in een alkylbromide.
Onder invloed van licht kan tetrabroommethaan reageren met een aantal organische verbindingen tot gekleurde stoffen. Daarom is het gebruikt in lichtgevoelige materialen o.a. voor fotokopiëren.[1]
Gesmolten tetrabroommethaan heeft een hoge dichtheid en wordt daarom gebruikt in de mineralogie voor het scheiden van mineralen op basis van hun soortelijk gewicht.
Het is niet brandbaar en wordt daarom verwerkt in sommige materialen om de brandweerstand ervan te verhogen.
Zie ook
Externe links

- (en) Gegevens van Tetrabroommethaan in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
- (en) MSDS van tetrabroommethaan
| Bronnen, noten en/of referenties |
| Halomethanen | ||||||||
|---|---|---|---|---|---|---|---|---|
|

