Adamantaan
Adamantaan is een gebrugde organische verbinding met als brutoformule C10H16. De naam adamantaan komt van het Griekse adamas, hetgeen diamant betekent. De structuur van adamantaan lijkt zeer sterk op die van diamant, maar de eigenschappen verschillen wezenlijk. Bovendien is diamant een van de allotropen van koolstof en zijn er dus - in tegenstelling tot adamantaan - geen koolstof-waterstofbindingen aanwezig.
Adamantaan
| ||||
| Structuurformule en molecuulmodel | ||||
 | ||||
Structuurformule van adamantaan | ||||
 | ||||
Molecuulmodel van adamantaan | ||||
Adamantaankristallen | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C10H16 | |||
| IUPAC-naam | tricyclo[3.3.1.13,7]decaan | |||
| Molmassa | 136,23404 g/mol | |||
| SMILES | C1C2CC3CC1CC(C2)C3 | |||
| InChI | 1S/C10H16/c1-7-2-9-4-8(1)5-10(3-7)6-9/h7-10H,1-6H2 | |||
| CAS-nummer | 281-23-2 | |||
| EG-nummer | 281-23-2 | |||
| PubChem | 9238 | |||
| Beschrijving | Wit tot bijna wit poeder | |||
| Vergelijkbaar met | memantine, rimantadine, amantadine | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H400 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P273 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | 1,07 g/cm³ | |||
| Smeltpunt | 270 °C | |||
| Sublimatiepunt | 209-212 °C | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | kubisch vlakgecentreerd | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
De molecule kan opgevat worden als 3 verknoopte cyclohexaanringen die allen een stoelconformatie hebben. Adamantaan is het eenvoudigste der diamantoïden, koolwaterstoffen met de algemene brutoformule C4n+6H4n+12.
Geschiedenis
Adamantaan is een natuurproduct: het komt in kleine hoeveelheden in aardolie voor en werd voor het eerst geïsoleerd in 1933 door S. Landa en S. Machacek uit aardolie uit het dorp Hodonín in Moravië. Adamantaan werd voor het eerst in het laboratorium bereid in 1941 door Vladimir Prelog en R. Seiwerth. Een praktische syntheseroute werd ontdekt door P. Schleyer en zijn medewerkers. Deze route werd later geoptimaliseerd.
Synthese
Adamantaan wordt tegenwoordig bereid vanuit het gehydrogeneerde dimeer van cyclopentadieen:
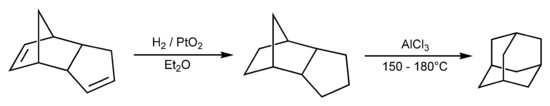 Synthese van adamantaan
Synthese van adamantaan
Als de verbinding in waterstofchloridegas over een palladium-aluminakatalysator wordt geleid ontstaat adamantaan. Jaarlijks wordt meer dan 10.000 ton adamantaan geproduceerd voor onder meer het gebruik in plastics en in geneesmiddelen.
Kristalstructuur en eigenschappen
Adamantaan sublimeert (209-212 °C) voor het smelt (270 °C) en ruikt enigszins naar kamfer. Het is een zeer symmetrische molecule: het behoort tot de puntgroep Td.
Röntgenkristallografie en elektronendiffractie laten zien dat de bindingslengte van de koolstof-koolstofbinding 154 pm bedragen en de hoeken 109,5°. Ieder koolstofatoom is sp3-gehybridiseerd. Adamantaan kristalliseert uit in een kubisch vlakgecentreerd kristalstelsel. Het behoort tot de ruimtegroep Fm3m en de lengte van de eenheidscel bedraagt 9,426 ± 0,008 Å. Per eenheidscel komen 4 adamantaanmoleculen voor. De kubische kristalstructuur gaat over naar een minder symmetrische tetragonale structuur (ruimtegroep P421c) met als eenheidscelparameters:
- a = 6,641 Å
- c = 8,875 Å
Hierin komen per eenheidscel 2 adamantaanmoleculen voor.[1] Deze kristaltransformatie treedt ook op wanneer adamantaan onder hoge druk (boven 0,5 GPa) wordt gebracht.[2]
Chemische eigenschappen en reacties
Adamantaan is een zeer stabiele molecule en weinig reactief. Reacties vinden over het algemeen plaats op het bruggende koolstofatoom, maar ook het tussenliggende koolstofatoom reageert onder bepaalde omstandigheden.
Adamantaan-kation
Het adamantaan-kation (meestal adamantylkation genoemd) kan bereid worden door 1-fluoradamantaan te laten reageren met antimoon(V)fluoride. Het carbokation is bijzonder stabiel.[3]
Oxidatie
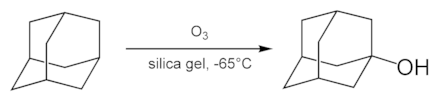
Adamantaan kan vlot geoxideerd worden tot het overeenkomstig keton (adamanton) door behandeling met zwavelzuur bij 80 °C:
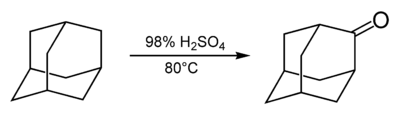 Oxidatie van adamantaan
Oxidatie van adamantaan
De gevormde carbonylgroep vormt nu een startpunt voor de synthese van verscheidene derivaten.
Bromering
Adamantaan reageert snel met verscheidene bromeringsreagentia, zoals dibroom. De mate van bromering is afhankelijk van de gebruikte katalysator en de temperatuur. Zo leidt het verhitten van adamantaan met dibroom tot vorming van 1-broomadamantaan, terwijl onder toevoeging van lewiszuren (zoals aluminiumchloride) hogere gebromeerde derivaten ontstaat.
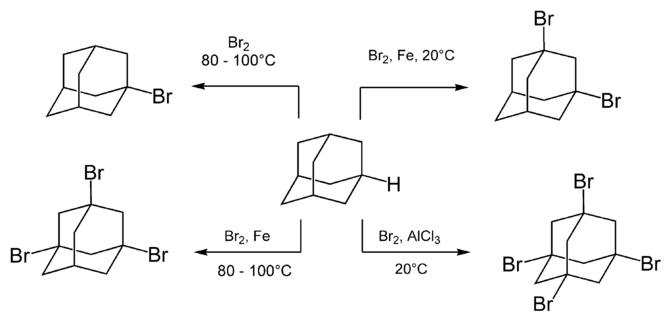 Bromering van adamantaan
Bromering van adamantaan
Opmerkelijk is dat het toevoegen van een lewiszuur verhoogt de reactiesnelheid, terwijl bestraling met licht noch toevoeging van radicalaire initiatoren een effect hebben op de kinetiek van de reactie. Dit toont aan dat de bromering niet radicalair, maar ionair verloopt (meer dan waarschijnlijk via het stabiele adamantylkation).[1]
Carboxylering
De carboxylering van adamantaan tot het overeenkomstig carbonzuur wordt uitgevoerd met mierenzuur als reagens en koolstoftetrachloride als oplosmiddel:[4]
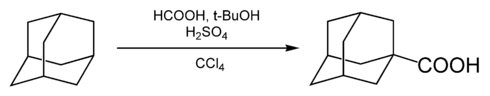 Carboxylering van adamantaan
Carboxylering van adamantaan
Daarbij worden zwavelzuur en tert-butanol toegevoegd om het intermediair adamantylkation te vormen. De carboxylering zelf vindt plaats doordat mierenzuur en zwavelzuur in situ koolstofmonoxide genereren.
Toepassingen
Adamantaan wordt in polymeren gebruikt om de tolerantie ten opzichte van oplosmiddelen, andere chemische stoffen en hitte te vergroten. Sommige derivaten van adamantaan zijn belangrijk in de farmaceutische industrie, zoals amantadine.
Diamantoïden
Adamantaan is het eenvoudigste voorbeeld van een diamantoïde. Hogere diamantoïden, moleculen die gelijken op de moleculaire structuur van diamant, zijn geïsoleerd uit aardolie. Tevens zijn sommige van deze verbindingen in het laboratorium gesynthetiseerd. Een voorbeeld is het tetramantaan. Dit is tevens het eerste diamantoïde dat chiraal is. Elk opeenvolgend diamantoïde is qua structuur gezien complexer. Zo bestaan van pentamantaan 9 isomeren met de formule C26H32 en één isomeer met de formule C25H30.
Zie ook
Externe links
- (en) MSDS van adamantaan
Bronnen, noten en/of referenties
|