Cyclopentadieen
Cyclopentadieen is een organische verbinding met als brutoformule C5H6. De stof komt voor als een heldere, kleurloze vloeistof met een terpentijnachtige geur. Bij kamertemperatuur dimeriseert de stof tot dicyclopentadieen via een diels-alderreactie. Door destillatie bij atmosferische druk (bij 180 °C) wordt het dimeer gekraakt, waarbij cyclopentadieen teruggevormd wordt.
Cyclopentadieen
| |||||
| Structuurformule en molecuulmodel | |||||
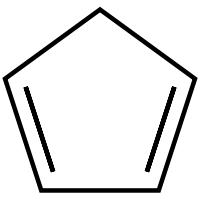 | |||||
Structuurformule van cyclopentadieen | |||||
| Algemeen | |||||
| Molecuulformule (uitleg) | C5H6 | ||||
| IUPAC-naam | 1,3-cyclopentadieen | ||||
| Molmassa | 66,10 g/mol | ||||
| SMILES | C1C=CC=C1 | ||||
| InChI | 1/C5H6/c1-2-4-5-3-1/h1-4H,5H2 | ||||
| CAS-nummer | 542-92-7 | ||||
| EG-nummer | 208-835-4 | ||||
| PubChem | 7612 | ||||
| Beschrijving | Kleurloze vloeistof met terpeenachtige geur | ||||
| Vergelijkbaar met | dicyclopentadieen | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H225 - H301 - H311 - H332 - H371 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | geen | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vloeibaar | ||||
| Kleur | kleurloos | ||||
| Dichtheid | 0,8021 g/cm³ | ||||
| Smeltpunt | −97,2 °C | ||||
| Kookpunt | 40,0 °C | ||||
| Vlampunt | 25 °C | ||||
| Goed oplosbaar in | benzeen, tolueen, hexaan | ||||
| Onoplosbaar in | water | ||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
De verbinding wordt in de organometaalchemie veel gebruikt als uitgangsstof voor het populaire ligand cyclopentadienyl (meestal afgekort tot Cp) in cyclopentadienylcomplexen. Cyclopentadieen en zijn dimeer kunnen ook als ligand optreden, maar daar zijn slechts weinig voorbeelden van bekend.
Metallolen zijn derivaten van cyclopentadieen waarbij het verzadigde koolstofatoom is vervangen door een hetero-atoom. Voorbeelden van dergelijke verbindingen zijn borool, bismool en stibool.
Synthese
Cyclopentadieen kan gemakkelijk bereid worden door het kraken van het dimeer dicyclopentadieen. Beide kunnen wel uit steenkoolteer of uit nafta (door middel van kraken) geïsoleerd worden.
Eigenschappen
De waterstofatomen aan het verzadigde koolstofatoom in cyclopentadieen ondergaan een snelle [1,5]-sigmatrope omlegging, waardoor zij op alle posities van de ring kunnen voorkomen. Bij kamertemperatuur vertoont cyclopentadieen in het NMR-spectrum slechts één signaal bij 4,8 ppm. Bij lagere temperatuur treedt een splitsing van signalen op die overeenkomt met de conventionele structuurformule van de verbinding.
De verbinding is zwak zuur (pKa = 16), hetgeen minder gebruikelijk is voor een koolwaterstof. Deze zuursterkte wordt veroorzaakt doordat de gevormde zuurrest (het cyclopentadienylanion) gestabiliseerd wordt door de energetisch gunstige aromaticiteit ervan. Deprotonering gaat zelfs makkelijk met behulp van de hydroxiden van de alkalimetalen. Het cyclopentadienylanion is een zwak nucleofiel in organische reacties of vormt makkelijk complexen met een grote verscheidenheid aan overgangsmetalen. Een voorbeeld van deze groep verbindingen is ferroceen, één der metallocenen.
Reactiviteit
Cyclopentadieen reageert makkelijk in diels-alderreacties met diënofielen. Dit is te wijten aan het feit dat de dubbele bindingen in de molecule in een permanente cis-configuratie ten opzichte van de enkele binding staan, hetgeen de vereiste configuratie is om een diels-alderreactie te ondergaan.
Toepassingen
Cyclopentadieen reageert met lijnzaadolie dat, onder invloed van zuurstof, sneller droogt. Deze eigenschap kan de droogtijd van olieverfschilderijen bekorten, maar ook het hele schilderij bedreigen doordat het canvas gaat rotten.
Zie ook
Externe links

- (en) Gegevens van Cyclopentadieen in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
- NIOSH Pocket Guide to Chemical Hazards
| Cycloalkenen | ||||||||
|---|---|---|---|---|---|---|---|---|
|
| Zie de categorie Cyclopentadiene van Wikimedia Commons voor mediabestanden over dit onderwerp. |


