Sublimatiepunt
Het sublimatiepunt is de temperatuur waarbij de vaste fase en gasfase van een bepaalde stof naast elkaar bestaan: bij het toevoeren van warmte verdampt de vaste stof (sublimatie), bij het onttrekken van warmte rijpt de damp. Van een sublimatiepunt is alleen sprake bij ontbreken van een vloeistoffase, zoals het geval is bij koolstofdioxide onder atmosferische druk.
Sublimatielijn
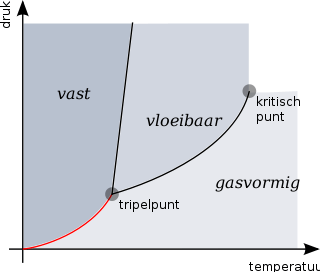
Het sublimatiepunt is afhankelijk van de druk. In een fasediagram waarbij op de assen de temperatuur en druk zijn uitgezet (een p,T-diagram) liggen de sublimatiepunten op één lijn, de sublimatielijn. Deze lijn eindigt bij het tripelpunt: bij hogere druk en/of hogere temperatuur gaat de overgang van vaste stof naar gas via de vloeistoffase.
De sublimatielijn is ook de relatie tussen de temperatuur en de dampdruk van de vaste stof.
Lijst
De volgende stoffen hebben bij atmosferische druk een sublimatiepunt:
| stofnaam | T (K) |
|---|---|
| ethyn | 189 |
| kooldioxide | 194,7 |
| aluminiumchloride | 456 |
| salmiak | 613 |
| ammoniumbromide | 725 |
| arseen | 887 |
| aluminiumfluoride | 1530 |
| grafiet | ±3920 |