Distikstofpentaoxide
Distikstofpentaoxide, ook wel distikstofpentoxide en afgekort tot DNPO, is een anorganische verbinding met als brutoformule N2O5. Het een van de stikstofoxiden. Distikstofpentaoxide is een onstabiele, gevaarlijke verbinding die ooit, opgelost in chloroform, werd gebruikt als nitrerend reagens. Voor dit doel wordt tegenwoordig nitroniumtetrafluorboraat (NO2BF4) gebruikt.
Distikstofpentaoxide
| ||||
| Structuurformule en molecuulmodel | ||||
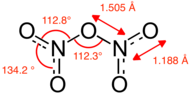 | ||||
Structuurformule en van distikstofpentaoxide (moleculaire vorm) | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | N2O5 | |||
| IUPAC-naam | distikstofpentaoxide | |||
| Andere namen | salpeterzuuranhydride, nitroniumnitraat, nitrylnitraat, DNPO | |||
| Molmassa | 108,01 g/mol | |||
| SMILES | [O-][N+](=O)O[N+]([O-])=O | |||
| EG-nummer | 233-264-2 | |||
| PubChem | 66242 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | (bij 18 °C) 1,642 g/cm³ | |||
| Smeltpunt | 41[1] °C | |||
| Goed oplosbaar in | chloroform | |||
| Slecht oplosbaar in | tetrachloormethaan | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | hexagonaal | |||
| Dipoolmoment | 1,39 D | |||
| Thermodynamische eigenschappen | ||||
| ΔfG | 114,1 kJ/mol | |||
| ΔfH | +11,3 kJ/mol | |||
| ΔfH | −43,1 kJ/mol | |||
| S | 355,6 J/mol·K | |||
| S | 178,2 J/mol·K | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Distikstofpentaoxide heeft de zeldzame eigenschap dat zij, afhankelijk van de omstandigheden, twee verschillende structuren kan aannemen. Doorgaans is het een zout, dat kan beschreven worden als nitroniumnitraat, maar soms komt het voor in moleculaire vorm:
Synthese en eigenschappen
Distikstofpentaoxide werd voor het eerst beschreven door Henri Étienne Sainte-Claire Deville in 1840. Hij liet zilvernitraat reageren met chloorgas, waarbij onder andere distikstofpentaoxide werd gevormd.[2][3]
Andere methoden om distikstofpentaoxide te bereiden zijn:
- De reactie van nitraten, bijvoorbeeld natriumnitraat, met nitroniumtetrafluorboraat:
- Uit de reactie van distikstoftetraoxide met ozon:
- Elektrolyse van salpeterzuur in aanwezighheid van distikstoftetraoxide:[4]
- Voor een kleinschalige laboratoriumsynthese wordt salpeterzuur gedehydrateerd met difosforpentaoxide:[5]
Eigenschappen en reactiviteit
De hydrolyse van distikstofpentaoxide levert salpeterzuur. De stof kan daarmee opgevat worden als het anhydride van salpeterzuur:
Distikstofpentaoxide bestaat als kleurloze kristallen die iets boven kamertemperatuur sublimeren. Daarnaast is het zout bij kamertemperatuur niet echt stabiel: het ontleed bij 20°C met een halfwaardetijd van ongeveer 10 uur langzaam in stikstofdioxide en zuurstofgas. Bij 0°C bedraagt de halfwaardetijd ongeveer 10 dagen.[6][7]
Structuur
Vast distikstofpentaoxide is een zout, opgebouwd uit het lineaire nitronium-kation (NO2+) en het vlakke nitraat-anion. Beide stikstofatomen hebben een oxidatiegetal van +5.
Distikstofpentaoxide in moleculaire vorm kan bestaan in de gasfase, na sublimatie van de vaste stof, of als ze in apolaire oplosmiddelen zoals tetrachloormethaan wordt opgelost. In de gasfase is de hoek O–N–O 133° en de hoek N–O–N 114°. Als gasvormig distikstofpentaoxide snel wordt afgekoeld ontstaat een metastabiele vaste moleculaire vorm, bij temperaturen boven −70°C wordt deze op exotherme wijze omgezet in de zoutvorm.[5]
Reacties en toepassingen
Distikstofpentaoxide, als oplossing in chloroform, werd vroeger gebruikt als reagens om een nitrogroepen in organische verbindingen, doorgaan aromaten, te introduceren. Een voorbeeld is de nitrering van benzeen tot nitrobenzeen:
Distikstofpentaoxide wordt toegepast in explosieven.[3][8]
In de atmosfeer vormt distikstofpentaoxide een belangrijk reservoir voor diverse stoffen uit de NOx-groep die (mede) verantwoordelijk zijn voor het gat in de ozonlaag.
Toxicologie en veiligheid
Distikstofpentaoxide is een sterke oxidator, die explosieve mengsels vormt met organische verbindingen en ammoniumzouten. De ontleding van distikstofpentaoxide leidt tot zeer toxische dampen van stikstofdioxide.
Bronnen, noten en/of referenties
|