Nitroniumion
Het nitronium-ion is een zeer instabiel kation met als brutoformule NO2+, dat kan ontstaan door het verwijderen van een elektron uit stikstofdioxide (NO2), of door het onttrekken van een molecule water aan geprotoneerd salpeterzuur. Het ion wordt soms ook foutief aangeduid als nitryl-ion, maar dat suggereert onterecht dat het deeltje een radicaal is.
Vorming
Het nitroniumion is niet stabiel genoeg dat het onder normale omstandigheden kan bestaan, maar het wordt op uitgebreide schaal toegepast als elektrofiel in de aromatische nitrering. Het ion wordt met dat doel in situ bereid door zwavelzuur en salpeterzuur met elkaar te mengen, waarbij de volgende evenwichtsreactie optreedt:
Eigenschappen
Het nitroniumion bestaat ook in de vaste vorm van distikstofpentoxide (N2O5), dat bestaat als een ionogene vaste stof, bestaande uit nitroniumionen en nitraat-ionen: formeel dus (NO2+)(NO3−). In de vloeibare en gasfase bestaat de stof echter in de moleculaire vorm: N2O5. Er zijn een paar nitroniumzouten beschreven met niet-nucleofiele anionen: zo is nitroniumperchloraat isoleerbaar, maar uiterst reactief.
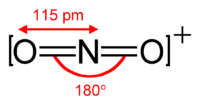
Het nitroniumion is iso-elektronisch met koolstofdioxide en neemt eveneens een lineaire moleculaire geometrie aan.
Verwante verbindingen
De stoffen nitrylfluoride (NO2F) en nitrylchloride (NO2Cl) zijn geen nitroniumzouten, maar moleculaire stoffen, wat blijkt uit de lage kookpunten van beide stoffen (−72 °C en −6 °C respectievelijk) en de korte N-X bindingslengten:[1]
- N-F-binding: 135 pm
- N-Cl-binding: 184 pm
Het opnemen van één elektron leidt tot het neutrale nitrylradicaal. Dit is een tamelijk stabiele component, ondanks het feit dat het een radicaal is, en eigenlijk meer bekend onder de naam stikstofdioxide.
Het verwante negatief geladen deeltje, NO2−, is het nitriet-ion.
Bronnen, noten en/of referenties
|