Distikstoftrioxide
Distikstoftrioxide is een chemische verbinding met de molecuulformule N2O3. Dit diepblauw gekleurd gas[1] is een van de binaire stikstofoxiden. De stof wordt gevormd door het mengen van equimolaire hoeveelheden (evenveel mol van beide verbindingen) stikstofmonoxide en stikstofdioxide en het mengsel vervolgens tot onder −21 °C te koelen:[2]
Distikstoftrioxide
| ||||
| Structuurformule en molecuulmodel | ||||
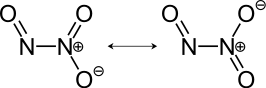 | ||||
Resonantiestructuren van distikstoftrioxide | ||||
 | ||||
Molecuulmodel van distikstoftrioxide | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | N2O3 | |||
| IUPAC-naam | distikstoftrioxide | |||
| Andere namen | salpeterig anhydride, stikstofsesquioxide | |||
| Molmassa | 76,01 g/mol | |||
| SMILES | [O-][N+](=O)N=O | |||
| CAS-nummer | 10544-73-7 | |||
| EG-nummer | 234-128-5 | |||
| PubChem | 61526 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | gasvormig | |||
| Kleur | blauw | |||
| Dichtheid | 1,783 g/cm³ | |||
| Smeltpunt | −100,7 °C | |||
| Kookpunt | (ontleedt) 3,5 °C | |||
| Goed oplosbaar in | water, di-ethylether | |||
| Geometrie en kristalstructuur | ||||
| Dipoolmoment | 2,122 D | |||
| Thermodynamische eigenschappen | ||||
| ΔfH | +91,20 kJ/mol | |||
| S | 314,63 J/mol·K | |||
| C | 65,3 J/mol·K | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Distikstoftrioxide is alleen isoleerbaar bij lage temperatuur, en alleen als vloeistof of vaste stof. Bij hogere temperaturen ligt het evenwicht aan de kant van de samenstellende gassen met Kdiss = 193 kPa (25 °C).[3]
Distikstoftrioxide kan ook worden gemaakt uit salpeterzuur en arseen(III)oxide:
Structuur en binding
Standaard stikstof-stikstofbindingen hebben de lengte zoals deze in hydrazine voorkomt: 145 pm. In N2O3 is de binding echter ongebruikelijk lang: 186 pm. Hiermee vertoont de verbinding overeenkomst met enkele andere stikstofoxides, zoals distikstoftetroxide (175 pm). Het N2O3 molecuul is vlak en heeft Cs-symmetrie. De in onderstaande figuren weergeven maten zijn gebaseerd op lagetemperatuur-microgolfspectroscopie van gasvormig N2O3:[2]
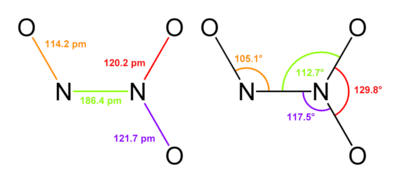
N2O3 is de watervrije (anhydride-)vorm van het instabiele salpeterigzuur (HNO2), wat ook ontstaat bij het oplossen van N2O3 in water. Op basis van het feit dat N2O3 een anhydridevorm is zou een andere structuur verwacht worden, namelijk O=N–O–N=O, maar dit isomeer wordt niet waargenomen. Als het salpeterigzuur niet snel na zijn vorming wordt gebruikt treedt een autoredoxreactie op naar salpeterzuur en stikstofmonoxide. Nitrieten worden soms bereid door N2O3 aan basische oplossingen toe te voegen.
Externe links
- (en) National Pollutant Inventory - Oxides of nitrogen fact sheet
- (en) Webelements: Compound data - dinitrogen trioxide
- (en) Oxides of nitrogen - synthesis and uses
- (en) Ivtantermo - dinitrogen trioxide table of values
Bronnen, noten en/of referenties
|
| Zie de categorie Dinitrogen trioxide van Wikimedia Commons voor mediabestanden over dit onderwerp. |