Bariumnitraat
Bariumnitraat is een goed oplosbaar bariumzout van salpeterzuur, met als brutoformule Ba(NO3)2. De stof is een sterke oxidator. Het komt voor als wit/grijs kristallijn poeder of als naaldvormige kristallen.
Bariumnitraat
| ||||
| Structuurformule en molecuulmodel | ||||
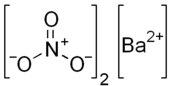 | ||||
Structuurformule van bariumnitraat | ||||
 | ||||
Bariumnitraat-kristallen | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | Ba(NO3)2 | |||
| IUPAC-naam | bariumnitraat | |||
| Molmassa | 261,3368 g/mol | |||
| SMILES | [N+](=O)([O-])[O-].[N+](=O)([O-])[O-].[Ba+2] | |||
| InChI | 1S/Ba.2NO3/c;2*2-1(3)4/q+2;2*-1 | |||
| CAS-nummer | 10022-31-8 | |||
| EG-nummer | 233-020-5 | |||
| PubChem | 24798 | |||
| Beschrijving | Wit-grijs poeder | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H302 - H332 | |||
| EUH-zinnen | geen | |||
| P-zinnen | geen | |||
| Opslag | Tussen 5 en 30°C, droog en afgesloten bewaren in afwezigheid van brandbare stoffen, vonk- en warmtebronnen.[1] | |||
| EG-Index-nummer | 056-002-00-7 | |||
| VN-nummer | 1446 | |||
| MAC-waarde | 0,5[1] | |||
| LD50 (ratten) | (oraal) 355[1] mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast[1] | |||
| Kleur | wit[1] | |||
| Dichtheid | 3,2[1] g/cm³ | |||
| Smeltpunt | (ontleedt) 592[1] °C | |||
| Oplosbaarheid in water | 90[1] g/l | |||
| Goed oplosbaar in | water | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Bariumnitraat kan op talloze manieren worden bereid:
Toepassingen
Bariumnitraat wordt gebruikt in pyrotechnische sassen als oxidator en/of voor vlamkleuring. Bariumnitraat kleurt groen wanneer er een chloordonor in de sas aanwezig is. Hier wordt meestal PVC of parlon voor gebruikt. Deze stoffen staan elementair chloor af als ze sterk verhit worden. Wanneer er geen chloordonor aanwezig is ontstaat een felle witte vlam door de vorming van bariumoxide (BaO). Een groene vlam komt voort uit de vorming van bariummonochloride (BaCl+).
In de anorganische chemie wordt bariumnitraat vaak gebruikt als een oplosbaar bariumzout nodig is. Een alternatieve, niet-oxiderende bariumverbinding is bariumjodide.
Toxicologie en veiligheid
Bariumnitraat is giftig bij opname met de mond, het wordt daarom sterk aanbevolen tijdens het werken met bariumnitraat een stofmasker te dragen, zeker wanneer het fijn gepoederd is. Metaalpoeders kunnen spontaan ontbranden wanneer ze gemengd zijn met bariumnitraat, zeker wanneer het bariumnitraat vochtig is. Dit is overigens het geval bij alle nitraatverbindingen.
Nitraatverbindingen kunnen niet spontaan detoneren wanneer ze in contact komen met reducerende stoffen. Ze zorgen er alleen voor dat de organische verbinding een deflagratie ondergaat. Hier bestaan veel misverstanden over waardoor zulke stoffen meteen door sommige mensen onterecht als zeer gevaarlijk worden gezien.
Externe links
- (en) Gegevens van Bariumnitraat in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
- (en) MSDS van bariumnitraat
Bronnen, noten en/of referenties
|

