Dizuurstof
Dizuurstof of moleculaire zuurstof (O2) is de belangrijkste enkelvoudige stof van het element zuurstof. Het is bij kamertemperatuur een kleurloos, reukloos en smaakloos gas. Het wordt ook wel zuurstofgas genoemd en vormt een belangrijk bestanddeel van lucht. Dizuurstof wordt ook gewoon zuurstof genoemd. Uit de context moet dan blijken of het element dan wel de diatomaire molecule bedoeld wordt.
Dizuurstof
| ||||
| Structuurformule en molecuulmodel | ||||
 | ||||
Structuurformule van dizuurstof | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | O2 | |||
| IUPAC-naam | dizuurstof | |||
| Andere namen | zuurstofgas, moleculaire zuurstof, LOX (in vloeibare vorm[1]) | |||
| Molmassa | 31,9988 g/mol | |||
| SMILES | O=O | |||
| InChI | 1/O2/c1-2 | |||
| CAS-nummer | 7782-44-7 | |||
| EG-nummer | 231-956-9 | |||
| PubChem | 977 | |||
| Beschrijving | Kleurloos gas | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H270 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P220 | |||
| EG-Index-nummer | 008-001-00-8 | |||
| VN-nummer | 1072 (gas onder druk) 1073 (vloeibaar) | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | gasvormig | |||
| Kleur | kleurloos | |||
| Dichtheid | (bij 0°C) 1,429 × 10−3[2] g/cm³ | |||
| Smeltpunt | −218,79 °C | |||
| Kookpunt | −182,95 °C | |||
| Oplosbaarheid in water | 39 × 10−3[2] g/l | |||
| Slecht oplosbaar in | water | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | kubisch | |||
| Dipoolmoment | 0 D | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||

Eigenschappen
Dizuurstof, oftewel zuurstofgas, maakt 20,95% van het volume en 23,2 % van de massa van de atmosfeer van de aarde uit. Het komt voor in twee toestanden: de grondtoestand (tripletzuurstof) en twee aangeslagen toestanden (singletzuurstof).
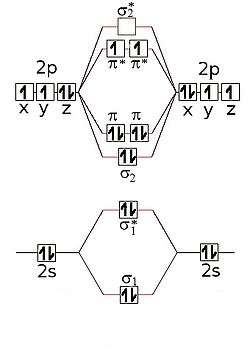
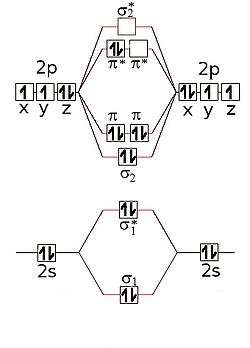
De meeste vormen van dizuurstof zijn paramagnetisch. Dit wordt veroorzaakt door de moleculaire elektronische structuur. Het molecuul heeft een dubbele binding. Als we de as van het molecuul als de z-as kiezen, kunnen de pz een sigmabinding aangaan. De px- en py-orbitalen moeten echter zijdelings overlappen in een combinatie met π-symmetrie. Iedere interactie leidt tot een bindende en een antibindende moleculaire orbitaal. Omdat bij het vullen van de orbitalen de antibindende orbitalen (die in totaal vier elektronen kunnen bevatten) maar met twee elektronen gevuld worden, zullen de twee elektronen met gelijke spin deze toestanden opvullen. Dit leidt tot een totale spin van S = 1/2 + 1/2 = 1 met drie waarden (−1,0,1) voor het spinkwantumgetal. Deze triplettoestand heeft een lagere energie dan de singlettoestand waar de spins gepaard worden. De ongepaarde elektronen van de triplettoestand maken de molecule een paramagnetisch diradicaal. Singletzuurstof kan onder bepaalde omstandigheden ook in kleine hoeveelheden gevormd worden; het is vooral voor levende wezens een gevaarlijke stof, die tot allerlei ontsporingen in de stofwisseling, mogelijk ook tot kanker, kan leiden. Daar staat tegenover dat witte bloedcellen zelf singletzuurstof maken om ongewenste cellen te vernietigen. Ook voor energiecycli is omzetting van triplet naar singlet nodig.
Bereiding
Op industriële schaal wordt dizuurstof gewonnen uit gefractioneerde destillatie van vloeibare lucht.
Synthese kan gebeuren via elektrolyse van water in een toestel van Hoffman, maar deze methode is tijdrovend en duur. Oplossen van natriumperoxide in water kan gebruikt worden om grotere hoeveelheden dizuurstof vrij te stellen. Ook de ontbinding van waterstofperoxide met behulp van mangaan(IV)oxide als katalysator wordt toegepast.
In de natuur is dizuurstof een belangrijk product van de fotosynthese.
Toepassingen

Dizuurstof is essentieel voor de celademhaling in alle aerobe organismen. Het wordt opgenomen in het lichaam via de longen, waar het bindt aan de heemgroep van hemoglobine.
Dizuurstof is essentieel voor alle verbrandingsreacties en is een belangrijke speler in corrosie.
Zuurstofgas is een industrieel gas en wordt in zuivere vorm veel toegepast in lasapparatuur en in de medische wereld voor de behandeling van mensen met ademhalingsproblemen. Ook in de luchtvaart en bij het (diep)duiken is het niet meer weg te denken (nitrox en trimix).
Dizuurstof kan vrij eenvoudig vloeibaar gemaakt worden. De vloeistof en de vaste stof die bij nog iets lagere temperaturen stabiel zijn, hebben een lichtblauwe kleur. Vloeibare zuurstof vindt toepassing in de ruimtevaart waar men het dan vaak met de Engelse afkorting LOX (Liquid OXigen) benoemt en bij grootverbruikers. Als chemische grondstof is het ook bijzonder belangrijk, bijvoorbeeld voor de gecontroleerde oxidatie van ethyleen naar ethyleenoxide (over een zilverkatalysator). Dit industriële proces levert een belangrijke grondstof voor de polymeerindustrie.
Andere planeten
Zuurstof is een tamelijk reactieve stof die zich langzaam verbindt met gesteenten. Daardoor kan zuurstof niet langdurig in de atmosfeer van een planeet voorkomen, tenzij er plantengroei is die zuurstof produceert.
Men zegt weleens dat er op een bepaalde planeet geen leven kan voorkomen omdat er in de atmosfeer geen zuurstof is. Dat is een vrij gewaagde veronderstelling, want het leven op die andere planeet kan best van een heel andere vorm zijn dan het leven op aarde. Bovendien is niet al het leven op aarde afhankelijk van zuurstof. Er zijn veel organismen die energie produceren middels andere mechanismen.
De omgekeerde veronderstelling is beter te verdedigen; als er zuurstof in de atmosfeer van een planeet is, dan moet die planeet plantaardig leven hebben.
Externe links


Bronnen, noten en/of referenties
|
| Diatomisch chemisch element |
|---|
|
Waterstof (H2) · Stikstof (N2) · Fosfor (P2) · Zuurstof (O2) · Fluor (F2) · Chloor (Cl2) · Broom (Br2) · Jood (I2) |