Ammoniumnitraat
Ammoniumnitraat is een zeer goed in water oplosbaar zout van salpeterzuur en ammoniak, met als brutoformule NH4NO3.
Ammoniumnitraat
| ||||
| Structuurformule en molecuulmodel | ||||
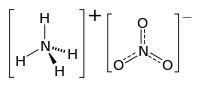 | ||||
Structuurformule van ammoniumnitraat | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | NH4NO3 | |||
| IUPAC-naam | ammoniumnitraat | |||
| Molmassa | 80,04336 g/mol | |||
| SMILES | [NH4+].[N+](=O)([O-])[O-] | |||
| InChI | InChI=1/NO3.H3N/c2-1(3)4;/h;1H3/q-1;/p+1/fNO3.H4N/h;1H/qm;+1 | |||
| CAS-nummer | 6484-52-2 | |||
| EG-nummer | 229-347-8 | |||
| PubChem | 22985 | |||
| Vergelijkbaar met | natriumnitraat, kaliumnitraat | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H272 - H315 - H319 - H335 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P220 - P261 - P305+P351+P338 | |||
| Hygroscopisch? | ja | |||
| Opslag | Stevig gesloten houden en niet in contact brengen met hitte, vonken of open vlammen. | |||
| LD50 (ratten) | (oraal) 2217 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | 1,72 g/cm³ | |||
| Smeltpunt | 169 °C | |||
| Kookpunt | 210 °C | |||
| Oplosbaarheid in water | (bij 0°C) 1190 g/L (bij 20°C) 1900 g/L (bij 40°C) 2860 g/L (bij 60°C)4210 g/L (bij 80°C) 6300 g/L (bij 100°C) 10.240 g/l | |||
| Goed oplosbaar in | water | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | trigonaal | |||
| Thermodynamische eigenschappen | ||||
| ΔfH | −365,6 kJ/mol | |||
| S | 151,1 J/mol·K | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Ammoniumnitraat is een belangrijke kunstmeststof omdat het zowel het kation (NH4+) als het anion (NO3−) stikstof bevat. De stof wordt ook in combinatie met benzine of kerosine (ANFO) als explosief gebruikt en het heeft in de mijnbouw dynamiet grotendeels verdrongen. De afkorting die wordt gebruikt in de explosieven en rakettechniek is AN van ammonium nitrate.
Toepassingen
Ammoniumnitraat kent tal van toepassingen:
- ijszakken;
- explosief (bijvoorbeeld Titanit);
- kunstmeststof;
- oxidator in experimentele vaste-brandstof raketten;
- synthese van verscheidene andere stikstofbevattende explosieven.
Ongelukken met ammoniumnitraat
Ammoniumnitraat als zuivere stof heeft een lage gevoeligheid en is dus zeer moeilijk tot ontploffing te brengen; niettemin is er minstens 1 geval bekend waarin een vrachtwagen vol ammoniumnitraat zonder bekende aanleiding explodeerde (er was niet genoeg van terug te vinden om de oorzaak te reconstrueren).
- 29 april 1942 : explosie in het bedrijf PCL, het latere Tessenderlo Chemie, waarschijnlijk door onbedachtzaam hardhandig verwijderen van aangekoekt ammoniumnitraat
- Tijdens een grote brand op 16 april en 17 april 1947 ontploften twee schepen met ammoniumnitraat (en zwavel), de Grand Camp en de High Flyer, in de haven van Texas City. 600 personen kwamen om.
- De explosie van 21 september 2001 in de AZF-fabriek in Toulouse, waarbij 29 doden vielen.
- Op 31 juli 2009 moesten in de Amerikaanse staat Texas de 70.000 inwoners van de stad Bryan geëvacueerd worden vanwege een grote brand in een grote opslagplaats van ammoniumnitraat. Op 10 lichtgewonden na vielen er verder geen slachtoffers omdat de stof niet ontplofte maar gecontroleerd uitgebrand is.
- Ammoniumnitraat is verantwoordelijk voor de explosie van een kunstmestfabriek in West (Texas) op 17 april 2013. Nadat er brand was uitgebroken ontplofte circa 30 ton AN. Hierbij vielen vijftien doden en 260 gewonden.[1]
Aanslagen met ammoniumnitraat
- De bomaanslag door Timothy McVeigh, in Oklahoma City in 1995, werd gepleegd met een vrachtwagen vol ammoniumnitraat en nitromethaan.[2]
- De bomaanslag door Anders Behring Breivik, in de regeringswijk van de Noorse hoofdstad Oslo op 22 juli 2011, werd veroorzaakt door explosieven op basis van ammoniumnitraat dat onttrokken werd uit kunstmeststof.
Chemische eigenschappen
Bij verhitting van ammoniumnitraat gaat de vaste stof door een aantal faseovergangen om uiteindelijk te ontleden in gasvormige producten. Tijdens deze ontleding gaat het een redoxreactie met zichzelf aan (een disproportionering). In het ammoniumkation heeft stikstof formeel een oxidatiegetal van -III, terwijl hetzelfde element in het nitraatanion een oxidatiegetal heeft van +V. De stof ontleedt door elektronen van het stikstofatoom uit ammonium aan het stikstofatoom uit nitraat af te staan, waardoor de oxidatiegetallen van beide atomen dichter bij nul komen te liggen.
Wanneer ammoniumnitraat wordt opgelost in water doet zich een endotherme reactie voor. Hierdoor is een van de toepassingen een zogenaamd instant coldpack. Dit is een zakje waarin ammoniumnitraat en water gescheiden van elkaar zitten. Door in het zakje te knijpen, komen beide stoffen met elkaar in contact, zodat de temperatuur meteen daalt tot ongeveer 0-2 °C. Naast ammoniumnitraat worden ook calciumnitraat of ureum gebruikt.
Bij verhitting van het zuivere zout komen lachgas en waterdamp vrij:
Samen met een brandstof gaat de ontleding nog verder door en wordt onder meer stikstof (N2) gevormd:
Door een destillatie van het zout met geconcentreerd zwavelzuur kan salpeterzuur teruggewonnen worden:
Externe link
| Bronnen, noten en/of referenties |

