Lood(II)nitraat
Lood(II)nitraat is het loodzout van salpeterzuur en heeft als brutoformule Pb(NO3)2. De stof komt voor als witte kristallen, die goed oplosbaar zijn in water.
Lood(II)nitraat
| ||||||
| Structuurformule en molecuulmodel | ||||||
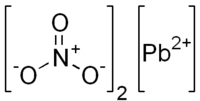 | ||||||
Structuurformule van lood(II)nitraat | ||||||
-nitrate-unit-cell-3D-balls.png) | ||||||
Kristalstructuur van lood(II)nitraat | ||||||
_nitrate_1.jpg) | ||||||
Lood(II)nitraat-kristallen | ||||||
| Algemeen | ||||||
| Molecuulformule (uitleg) | Pb(NO3)2 | |||||
| IUPAC-naam | lood(II)nitraat | |||||
| Andere namen | loodnitraat | |||||
| Molmassa | 331,2098 g/mol | |||||
| SMILES | [N+](=O)([O-])[O-].[N+](=O)([O-])[O-].[Pb+2] | |||||
| InChI | 1/2NO3.Pb/c2*2-1(3)4;/q2*-1;+2 | |||||
| CAS-nummer | 10099-74-8 | |||||
| EG-nummer | 233-245-9 | |||||
| PubChem | 24924 | |||||
| Beschrijving | wit poeder | |||||
| Waarschuwingen en veiligheidsmaatregelen | ||||||
| ||||||
| H-zinnen | H272 - H302 - H332 - H360 - H373 - H410 | |||||
| EUH-zinnen | geen | |||||
| P-zinnen | P201 - P220 - P273 - P308+P313 - P501 | |||||
| Carcinogeen | ja (IARC-klasse 2) | |||||
| EG-Index-nummer | 082-001-00-6 | |||||
| VN-nummer | 1469 | |||||
| ADR-klasse | Gevarenklasse 5.1 | |||||
| Fysische eigenschappen | ||||||
| Aggregatietoestand | vast | |||||
| Kleur | wit | |||||
| Dichtheid | 4,53[1] g/cm³ | |||||
| Smeltpunt | (ontleedt) 210[1] °C | |||||
| Oplosbaarheid in water | 522[1] g/l | |||||
| Goed oplosbaar in | water | |||||
| Slecht oplosbaar in | methanol, ethanol | |||||
| Brekingsindex | 1,782 (589 nm, 20 °C) | |||||
| Geometrie en kristalstructuur | ||||||
| Kristalstructuur | kubisch | |||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||||
| ||||||
Synthese
Lood(II)nitraat kan bereid worden door reactie van lood, lood(II)oxide of lood(II)carbonaat met salpeterzuur:
Kristalstructuur
Lood(II)nitraat vormt bij uitkristallisatie witte kristallen, die behoren tot het kubisch kristalstelsel (meer bepaald kubisch vlakgecentreerd). Het zout behoort tot ruimtegroep Pa3Z=4 en de lengte van een eenheidscel bedraagt 784 pm.
Eigenschappen
In tegenstelling tot vrijwel alle andere loodzouten (zoals lood(II)sulfaat, lood(II)carbonaat of lood(II)chloride), lost lood(II)nitraat zeer goed op in water. Net zoals alle nitraten is de verbinding een vrij krachtige oxidator.
Bij verhitting boven 470°C ontleedt het zout tot lood(II)oxide, stikstofdioxide en zuurstofgas:
Deze reactie wordt in het laboratorium weleens gebruikt om in situ stikstofdioxide te bereiden.
Toepassingen
Lood(II)nitraat werd vroeger regelmatig verwerkt in verven, maar nadien werd het vervangen door minder toxische alternatieven, met name titanium(IV)oxide. Het werd ook gebruikt in lucifers en vuurwerk, maar ook deze toepassing is gaandeweg sterk afgenomen. Tegenwoordig wordt het voornamelijk gebruikt als hitte-stabilisator in nylon en polyesters, als coating voor fotothermografisch papier en in rodenticiden.
In het laboratorium wordt het gebruikt om stikstofdioxide te genereren en als oxidator. In die laatste context wordt bij soms bij de Sommelet-reactie ingezet. Lood(II)nitraat wordt ook aangewend bij de synthese van isothiocyanaten uit dithiocarbamaten.
Toxicologie en veiligheid
Lood is giftig en contact met lood(II)nitraat kan leiden tot loodvergiftiging. Het is vermoedelijk carcinogeen volgens het IARC.
Externe links
Bronnen, noten en/of referenties
|



