Fenantreen
Fenantreen is een polycyclische aromatische koolwaterstof met als brutoformule C14H10. De stof komt voor als een witte kristallijne vaste stof, die onoplosbaar is in water. De moleculaire structuur bestaat uit drie aaneengesloten benzeenringen. Het is bijgevolg een structuurisomeer van antraceen. De naam fenantreen is een samentrekking van fenyl en antraceen. Fenantreen komt vrij in het lichaam na het roken van een sigaret. Het is een kankerverwekkende stof.[1]
Fenantreen
| ||||
| Structuurformule en molecuulmodel | ||||
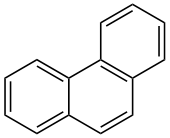 | ||||
Structuurformule van fenantreen | ||||
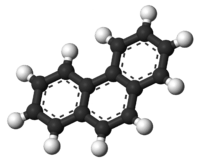 | ||||
Molecuulmodel van fenantreen | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C14H10 | |||
| IUPAC-naam | fenantreen | |||
| Molmassa | 178,2292 g/mol | |||
| SMILES | C1=CC=C2C(=C1)C=CC3=CC=CC=C32 | |||
| InChI | 1S/C14H10/c1-3-7-13-11(5-1)9-10-12-6-2-4-8-14(12)13/h1-10H | |||
| CAS-nummer | 85-01-8 | |||
| EG-nummer | 201-581-5 | |||
| PubChem | 995 | |||
| Beschrijving | Kristallijne vaste stof | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H302 - H315 - H319 - H335 - H410 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P261 - P273 - P305+P351+P338 - P501 | |||
| VN-nummer | 3077 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | 1,18 g/cm³ | |||
| Smeltpunt | 98,5 °C | |||
| Kookpunt | 332 °C | |||
| Goed oplosbaar in | benzeen, tolueen, tetrachloormethaan | |||
| Onoplosbaar in | water | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Fenantreen wordt vooral gewonnen, zoals antraceen, uit antraceenolie. Dit is de fractie met een kookpunt tussen 300 en 360°C, die door destillatie uit steenkoolteer wordt afgescheiden.
Synthese
Fenantreen kan gevormd worden uit (E)-stilbeen onder invloed van UV-licht en in de aanwezigheid van zuurstofgas of een andere geschikte oxidator. De dubbele binding in (E)-stilbeen wordt eerst in de Z-conformatie gebracht, waardoor de twee benzeenringen zo dicht bij elkaar liggen dat zij onder invloed van licht verbonden worden. Daardoor ontstaat de intermediaire vorm dihydrofenantreen, dat geoxideerd wordt tot fenantreen:
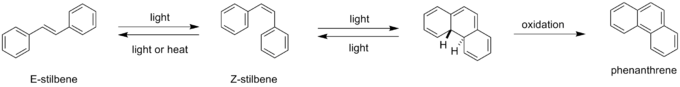 Synthese van fenantreen
Synthese van fenantreen
Een andere reactie om fenantreen te verkrijgen is de zogenaamde Bardhan-Sengupta-synthese.[2] Hierin wordt 2-(2-fenylethyl)-cyclohexanol, in aanwezigheid van difosforpentoxide, gecycliseerd tot 9,10-dihydrofenantreen dat met behulp van seleen geoxideerd wordt tot fenantreen:
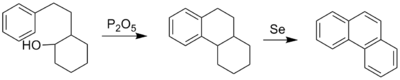 Synthese volgens de Bardhan-Sengupta-reactie.
Synthese volgens de Bardhan-Sengupta-reactie.
Eigenschappen en reacties
Fenantreen is stabieler dan antraceen, hetgeen wordt verklaard met de regel van Clar. Reacties met fenantreen vinden hoofdzakelijk plaats op de 9- en 10-positie (de twee koolstofatomen in de middelste benzeenring die geen deel uitmaken van de buitenste benzeenringen). Het ondergaat volgende reacties:
- Oxidatie tot fenantreenchinon met chroomzuur
- Reductie tot 9,10-dihydrofenantreen met waterstofgas en Raney-nikkel als katalysator (hydrogenering)
- Elektrofiele halogenering met dibroom tot 9-broomfenantreen
- Aromatische sulfonering met zwavelzuur tot 2- en 3-fenantreensulfonzuur
- Ozonolyse tot difenylaldehyde
Toepassingen
Fenantreen en derivaten van fenantreen, worden gebruikt voor de synthese van polyimiden[3] (polymeren die tegen hoge temperaturen zijn bestand), vloeibare kristallen,[4] geneesmiddelen[5] en landbouwchemicaliën.
Fenantreen kan omgezet worden in antraceen, dat een belangrijke grondstof is voor kleurstoffen (via de geoxideerd vorm antrachinon). Dit gebeurt door fenantreen eerst te hydrogeneren tot octahydrofenantreen, dat met behulp van een gepaste katalysator (bijvoorbeeld aluminiumchloride) in een isomerisatie om te zetten in octahydroantraceen, en dit vervolgens te dehydrogeneren tot antraceen.[6]
Externe links
- (en) MSDS van fenantreen
- (en) Gegevens van Fenantreen in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
| Polycyclische aromatische koolwaterstoffen | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|

