Fluoranteen
Fluoranteen is een polycyclische aromatische koolwaterstof met als brutoformule C16H10. De stof komt voor als gele tot groene naaldachtige kristallen, die zeer slecht oplosbaar zijn in water. De stof is geclassificeerd volgens het IARC in klasse 3, wat betekent dat het mogelijk carcinogeen is voor de mens.[1]
Fluoranteen
| ||||
| Structuurformule en molecuulmodel | ||||
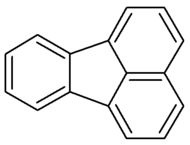 | ||||
Structuurformule van fluoranteen | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C16H10 | |||
| IUPAC-naam | fluoranteen | |||
| Andere namen | benzo[jk]fluoreen, 1,2-(1,8-naftyleen)benzeen | |||
| Molmassa | 202,2506 g/mol | |||
| SMILES | C1=CC=C2C(=C1)C3=CC=CC4=C3C2=CC=C4 | |||
| InChI | 1S/C16H10/c1-2-8-13-12(7-1)14-9-3-5-11-6-4-10-15(13)16(11)14/h1-10H | |||
| CAS-nummer | 206-44-0 | |||
| EG-nummer | 205-912-4 | |||
| PubChem | 9154 | |||
| Beschrijving | Gele tot groene kristallen | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H302 - H410 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P273 - P501 | |||
| Carcinogeen | mogelijk (IARC-klasse 3) | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | geel-groen | |||
| Dichtheid | (bij 0°C) 1,252 g/cm³ | |||
| Smeltpunt | 110,8 °C | |||
| Kookpunt | 375 °C | |||
| Vlampunt | 210 °C | |||
| Oplosbaarheid in water | (bij 25°C) 0,000265 g/l | |||
| Slecht oplosbaar in | water | |||
| Geometrie en kristalstructuur | ||||
| Dipoolmoment | 0 D | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Structuur en eigenschappen
De structuur kan opgevat worden als zijnde een benzeenring en een naftaleenmolecule die via een vijfring aan elkaar zijn gekoppeld. Het is een structuurisomeer van pyreen. Fluoranteen is thermisch minder stabieler dan pyreen, omdat de π-elektronen zich niet over de hele molecule kunnen delokaliseren. De benaming fluoranteen is afgeleid van de fluorescerende eigenschap onder invloed van UV-licht.
Fluoranteen-derivaten
Een aantal polycyclische aromatische verbindingen zijn afgeleid van fluoranteen:
Externe links
| Polycyclische aromatische koolwaterstoffen | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Bronnen, noten en/of referenties
|

