Tin(II)chloride
Tin(II)chloride is een tinzout van waterstofchloride, met als brutoformule SnCl2. De stof komt voor als kleurloze of witte kristallen, die goed oplosbaar zijn in water. Ze hydrolyseert evenwel in heet water. Tin(II)chloride kan voorkomen als anhydraat of als dihydraat (SnCl2 · 2 H2O).
Tin(II)chloride
| ||||
| Structuurformule en molecuulmodel | ||||
-chloride-xtal-1996-3D-balls-front.png) | ||||
Kristalstructuur van tin(II)chloride | ||||
_chloride.jpg) | ||||
Tin(II)chloride-kristallen | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | SnCl2 | |||
| IUPAC-naam | tin(II)chloride | |||
| Andere namen | dichloortin, tindichloride | |||
| Molmassa | (watervrij) 189,616 g/mol (dihydraat) 225,64656 g/mol | |||
| SMILES | Cl[Sn]Cl | |||
| CAS-nummer | (watervrij) 7772-99-8 (dihydraat) 10025-69-1 | |||
| EG-nummer | 231-868-0 | |||
| PubChem | 24479 | |||
| Beschrijving | Kleurloze of witte kristallen | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H302 - H314 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P280 - P305+P351+P338 - P310 | |||
| Opslag | Gescheiden van oxiderende stoffen, voeding en voedingsmiddelen. Droog bewaren. | |||
| VN-nummer | 3260 | |||
| ADR-klasse | Gevarenklasse 8 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | kleurloos-wit | |||
| Dichtheid | (watervrij) 3,95 g/cm³ (dihydraat) 2,71 g/cm³ | |||
| Smeltpunt | (watervrij) 246,8 °C (dihydraat) 37 °C | |||
| Kookpunt | (watervrij) 622-644 °C | |||
| Oplosbaarheid in water | (bij 0°C) 839 g/L (bij 20°C) 900 g/l | |||
| Goed oplosbaar in | water, ethanol, aceton, di-ethylether | |||
| Onoplosbaar in | xyleen | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | (watervrij) trigonaal | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Watervrij tin(II)chloride kan bereid worden door het verhitten van tin en waterstofchloride:
Het dihydraat wordt verkregen door een waterige oplossing te maken van de watervrije verbinding.
Structuur
Tin(II)chloride heeft een vrij elektronenpaar, zodat ze tijdens de gasfase bindingen aangaat. In vaste, kristallijne vorm bestaat tin(II)chloride uit lange ketens; de moleculen zijn met elkaar verbonden door middel van chloorbruggen. Het dihydraat vormt een coördinatieverbinding met tin: de eerste watermolecule bindt zich met tin, de tweede bindt zich met de eerste waterstofmolecule via een waterstofbrug.
chloride-structuren.png)
Toepassingen
Bij het galvaniseren wordt het in een zoutzuuroplossing gebruikt voor elektrolytische vertinning. Het tin wordt via elektrolyse afgezet aan de kathode en op die manier wordt het blik voor onder andere conservenblikken gemaakt.
Verder kent tin(II)chloride verschillende toepassingen:
- als reductor in laboratoria:
- bij de reductie van aromatische nitroverbindingen tot anilines
- bij de reductie van chinonen tot hydrochinonen
- bij de reductie van zilver, dat gebruikt wordt om spiegels te maken
- als fixeermiddel voor textielkleurstoffen
- als katalysator bij de bereiding van PLA
- als een voedseladditief met E-nummer E512 in sommige conserven en gebottelde voeding, waar het dient als een kleurstabilisator en antioxidant
- als reagens in de Stephen-aldehydesynthese, waarbij een nitril door middel van tin(II)chloride wordt gereduceerd tot een imine. Dit imine wordt verder gehydrolyseerd tot een aldehyde:[1]
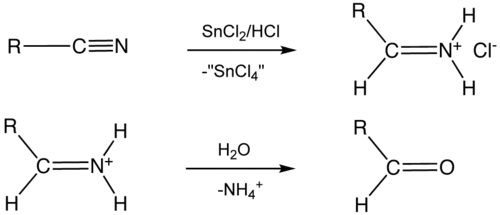 Reactieverloop van de Stephen-aldehydesynthese
Reactieverloop van de Stephen-aldehydesynthese
Toxicologie en veiligheid
De stof ontleedt bij verhitting, met vorming van giftige en corrosieve gassen. De stof is een sterk reductiemiddel en reageert met oxiderende stoffen zoals nitraten, peroxiden en basen.
De stof is irriterend voor de ogen en de luchtwegen. De drempelwaarde voor tin(II)chloride bedraagt 2 mg/m³.
Externe links


- (en) Gegevens van Tin(II)chloride in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
- (en) MSDS van tin(II)chloride
Bronnen, noten en/of referenties
|

