Waterstofbrug
Een waterstofbrug is een niet-covalente binding tussen een elektronenpaar op een sterk elektronegatief atoom (zuurstof, stikstof of fluor) en een naburig waterstofatoom, gebonden aan een ander sterk elektronegatief atoom. Waterstofbruggen, ook aangeduid als H-bruggen, komen onder meer voor tussen watermoleculen, waar ze van groot belang zijn voor de fysische eigenschappen van water (smeltpunt/ kookpunt; oppervlaktespanning). Ze komen echter ook in vele andere stoffen voor. Waterstofbruggen met een of twee fluoratomen zijn zelfs beduidend sterker: in het geval van het bifluoride-ion benaderen zij de sterkte van een covalente binding.
| Chemische binding |
|---|
| Dipool-dipoolinteracties
|
Moleculen (intramoleculair)
Moleculen (intermoleculair)
Zouten Metalen Covalente netwerken Theorieën Eigenschappen |
| Portaal |
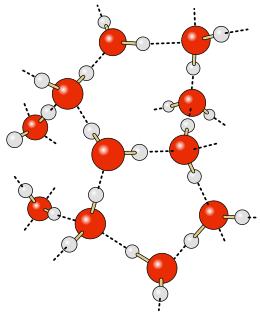
(aangegeven met zwarte streepjes)
Is een waterstofatoom verbonden aan een atoom met een zeer grote elektronegativiteit, zoals F, O of N (zelfs C in sommige gevallen) dan wordt de binding sterk polair. De elektronenwolk verschuift dan in de richting van F, O of N en dit atoom wordt negatief geladen. Het resultaat is dat het aan F, O, of N verbonden waterstofatoom positief wordt geladen. Omdat het waterstofatoom zo klein is, is de lading erop sterk geconcentreerd, zodat het met grote kracht een naburig dipoolmolecuul (of zelfs een dipool in hetzelfde molecuul) zeer dicht aan kan trekken. De waterstofbruggen zijn ongebruikelijk sterk vergeleken met andere dipool-dipoolkrachten.
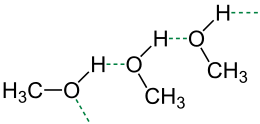
(aangegeven met groene streepjes)
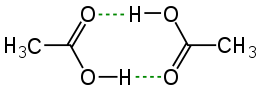
(aangegeven met groene streepjes)
Waterstofbruggen kunnen ook gevormd worden tussen waterstofatomen en elementen die een vrij elektronenpaar bezitten, bijvoorbeeld F, O, N en Cl. Hier wordt de waterstofbrug verklaard door de vorming van een polycentrisch molecuulorbitaal (PCMO) over drie atomen: H, het atoom waar H covalent op gebonden is en het atoom waarmee de waterstofbrug aangegaan wordt. Hierbij gaat het p-orbitaal van het atoom met het vrije elektronenpaar een belangrijke rol spelen.
Voorkomen
Waterstofbruggen komen o.a. voor in water en ammoniak, en ze zorgen er ook voor dat de twee strengen van DNA bijeenblijven door de complementaire baseparen te verbinden. De secundaire structuren van eiwitten, zoals de α-helix en de β-plaatstructuur (vouwbladstructuur), worden gevormd door het optreden van waterstofbruggen tussen verschillende peptidebindingen. De waterstofbruggen zijn ook de drijvende kracht achter het al dan niet hydrofiel of hydrofoob zijn van (delen van) moleculen.
Waterstofbruggen treden ook op in alcoholen en amines. Zodra een ethanolmolecuul tussen watermoleculen komt, vormt het waterstofatoom van de hydroxylgroep in ethanol een waterstofbrug met een H2O-molecuul. Hierbij komt energie vrij (het is dus een exotherme reactie), 22 kJ per mol bindingen.
Een speciale plaats wordt ingenomen door intramoleculaire waterstofbruggen: waterstofbruggen binnen hetzelfde molecuul. Ze treden onder andere op in α-hydroxyzuren. In tegenstelling tot de intermoleculaire waterstofbruggen zijn intramoleculaire bruggen zeer stabiel.
Invloed op stofeigenschappen
In ijs zijn de waterstofbruggen verantwoordelijk voor het feit dat ijs van 0 °C een kleinere dichtheid heeft dan water van 0°C. De waterstofbrug O···H—O is namelijk lineair. Dit feit en de veronderstelde sp3-hybridisatie bij het O atoom (tetraëdrische ladingswolken) heeft tot gevolg dat ijs een met diamant vergelijkbare tetraëdrische kristalstructuur heeft, met tussen de watermoleculen relatief veel lege ruimte. Bij het smelten van ijs stort deze structuur gedeeltelijk in en komen de watermoleculen gemiddeld dichter op elkaar te zitten.
Het optreden van waterstofbruggen heeft ook effect op de hoogte van het kookpunt van de verbindingen waarin ze optreden. Water heeft een veel hoger kookpunt dan op grond van zijn plaats in de rij H2X (met X = S, Se, Te, Po) verwacht kan worden. Zo is bijvoorbeeld water H2O een vloeistof, terwijl H2S een gas is bij kamertemperatuur.
De sterkte van de waterstofbrug vertoont een duidelijk isotoopeffect. Dit is goeddeels verantwoordelijk voor het feit dat het smeltpunt van zwaar ijs een aantal graden hoger ligt dan van gewoon ijs en zwaar water zijn hoogste dichtheid bereikt bij ongeveer 11 °C in plaats van ongeveer 4 °C. De vervanging van protonen door deuteronen heeft invloed op de wijze waarop eiwitten zich opvouwen en dit feit wordt gebruikt om het opvouwen van eiwitten te bestuderen.[1]
Bronnen, noten en/of referenties
|