Kathode
In een elektrisch systeem met twee polen of elektroden spreken we van kathode voor de pool waar de elektronen in gaan. De tegengestelde pool of elektrode heet de anode. De begrippen kathode en anode hebben betrekking op de richting van de doorgevoerde stroom. Dus afhankelijk of men een stroombron heeft of een stroomverbruiker kan de kathode positief of negatief zijn. In het geval van een stroombron is de kathode positief, in het geval van een stroomverbruiker is de kathode negatief.
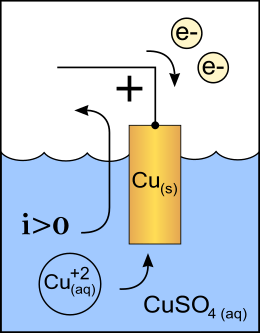
Men onderscheidt de twee elektroden naar de rol die zij spelen. Het pad waarlangs de elektronen de oplossing of schakeling ingeleid worden heet kathode (Grieks κάθοδος, weg naar beneden). Het pad waarlangs zij weggezogen worden heet anode (Grieks άνοδος, weg naar boven). Aan de kathode vindt een reductiereactie plaats, aan de anode een oxidatiereactie.
- In volgende gevallen is de kathode positief:
- De kathode in een galvanische cel is de pool waar een reductiereactie optreedt.
- In een cel waarin een elektrochemische reactie wordt gebruikt om een elektrische spanning te genereren (een batterij of accu) vindt de reductie plaats aan de positieve pool (de reductiereactie trekt de elektronen uit de chemische substantie die in contact staat met de pool). Dan is de positieve pool dus de kathode.
- In volgende gevallen is de kathode negatief:
- In een vacuümbuis is de kathode de pool waar elektronen uit worden vrijgemaakt.
- In een cel waarin de elektrochemische reactie door een externe elektrische spanning wordt gedreven (bij elektrolyse of het opladen van een accu) is de kathode de negatieve pool en de anode dus de positieve pool. Ook hier is de kathode de pool waar een reductiereactie optreedt.
Elektrochemische toepassing
- Aan de kathode vindt bij elektrolyse en bij galvanische cellen altijd een chemisch reductieproces plaats. Ook bij accumulatoren, ongeacht of de accu nu ontladen of opgeladen wordt.
- Aan de anode vindt bij elektrolyse en bij galvanische cellen altijd een chemisch oxidatieproces plaats. Ook bij accumulatoren, ongeacht of de accu nu ontladen of opgeladen wordt.
- Het ezelsbruggetje "KRAO" is van toepassing bij elektrochemische elementen : Kathode Reductie, Anode Oxidatie.
- Het ezelsbruggetje "KNAP" (Kathode Negatief, Anode Positief) geldt alleen voor een elektrochemische cel die door een externe spanningsbron wordt gedreven, zoals bij elektrolyse of het opladen van een batterij.
- Een handig ezelsbruggetje voor het toestel van Hofmann is OPA HeNK (O (zuurstof), Positief, Anode; H (waterstof), Negatief, Kathode).
- Een ander ezelsbruggetje voor het toestel van Hofmann is ZWAK (zuurstof, waterstof, anode, kathode)
Elektronische toepassing
- Bij elektronica componenten zoals de diode is de kathode de negatieve zijde en de anode de positieve zijde. Het ezelsbruggetje "KNAP" (Kathode Negatief, Anode Positief) is hier van toepassing.
Oplaadbare accu
Bij een accu is de positieve kant altijd met een + aangegeven en de negatieve kant altijd met een -. Een oplaadbare accu kan zowel stroomleverancier zijn als stroomverbruiker. In het geval hij fungeert als stroomleverancier zal de kathode positief zijn en de anode negatief. In het geval dat de accu wordt opgeladen is hij een stroomverbruiker en zal intern de redoxreactie worden omgedraaid. De positieve pool wordt dan tijdens het opladen anode genoemd en de negatieve pool de kathode.