Hexamine
Hexamine of hexamethyleentetramine is een gebrugde organische verbinding met als brutoformule C6H12N4. De zuivere stof komt voor als witte tot kleurloze kristallen zonder geur, die goed oplosbaar zijn in water. De verbinding is structureel verwant met adamantaan.
Hexamine
| ||||
| Structuurformule en molecuulmodel | ||||
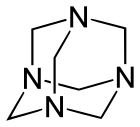 | ||||
Structuurformule van hexamine | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C6H12N4 | |||
| IUPAC-naam | 1,3,5,7-tetra-azatricyclo[3.3.1.13,7]decaan | |||
| Andere namen | hexamethyleentetramine, urotropine, aminoform, formine, 1,3,5,7-tetra-aza-adamantaan | |||
| Molmassa | 140,18628 g/mol | |||
| SMILES | C1N2CN3CN1CN(C2)C3 | |||
| InChI | 1S/C6H12N4/c1-7-2-9-4-8(1)5-10(3-7)6-9/h1-6H2 | |||
| CAS-nummer | 100-97-0 | |||
| EG-nummer | 202-905-8 | |||
| PubChem | 4101 | |||
| Beschrijving | Witte tot kleurloze kristallen zonder geur | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H228 - H317 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P210 - P280 | |||
| LD50 (muizen) | (oraal) 569 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit-kleurloos | |||
| Dichtheid | 1,27 g/cm³ | |||
| Sublimatiepunt | 285-295 °C | |||
| Vlampunt | 250 °C | |||
| Zelfontbrandings- temperatuur | 410 °C | |||
| Goed oplosbaar in | water, apolaire en polaire organische oplosmiddelen | |||
| Analytische methoden | ||||
| Klassieke analyse | IR, UV/VIS, HPLC, MS, zuur-basetitratie | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
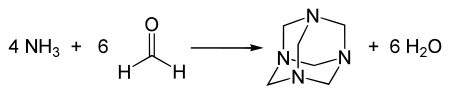
Hexamine wordt gesynthetiseerd door een oplossing van formaldehyde (formaline) in water te mengen met ammoniak:
De ontstane oplossing van hexamine kan voorzichtig worden ingedampt om de vrije kristallen te verkrijgen. Deze kristallen kunnen gezuiverd worden door sublimatie bij ongeveer 290°C.
Eigenschappen
Bij verhitting valt hexamine uiteen in ammoniak en formaldehyde, bij hogere temperaturen bestaan decompositieproducten voornamelijk uit waterstofcyanide, stikstofgas en in de aanwezigheid van zuurstof worden er stikstofoxiden, koolstofdioxide en koolstofmonoxide gevormd. De stof is een milde organische base door de aanwezigheid van vier stikstofatomen met allen nog één vrij elektronenpaar in een sp3-orbitaal.
Bij verbranding van hexamine komt een thermische energie vrij van circa 31.300 kJ/kg. Daarom wordt de stof ook gebruikt in vaste brandstoftabletten (Esbit).
Toepassingen
Hexamine wordt gebruikt in industriële toepassingen, zoals fotografie of tandheelkunde. Tevens is het een veel gebruikte stof in het organisch laboratorium. Er kunnen zowel aldehyden als amines mee gesynthetiseerd worden uit alkyl- of arylhalogeniden. De aminesynthese wordt ook wel de Delépine-reactie genoemd (naar Stéphane Marcel Delépine). Eerst wordt hexamine gekoppeld door middel van een SN1- of SN2-reactie, vervolgens leidt zure hydrolyse van het ontstane quaternaire ammoniumzout tot het vrije amine. De aldehydesynthese wordt de Sommelet-reactie genoemd (naar Marcel Sommelet); ze is analoog aan de Delépine-reactie maar de hydrolyse van het quaternaire ammoniumzout gebeurt in water.
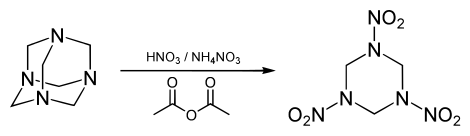
De reactie met salpeterzuur en ammoniumnitraat leidt tot vorming van cyclotrimethyleentrinitroamine, een explosieve stof die vaak afgekort wordt als RDX:
Hexamine kan dienen als zwakke base en vormt goede bufferoplossingen voor titraties.
De stof kan gebruikt worden als conserveringsmiddel tegen schimmels. Het officiële E-nummer is E239.
Externe links
- (en) MSDS van hexamine
- (en) Gegevens van Hexamine in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)