Formaldehyde
Formaldehyde of methanal is een gas met een zeer sterke, onaangename geur. Het is de eenvoudigste organische verbinding uit de stofklasse der aldehyden.
Formaldehyde
| ||||||
| Structuurformule en molecuulmodel | ||||||
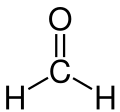 | ||||||
Structuurformule van formaldehyde | ||||||
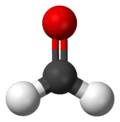 | ||||||
Molecuulmodel van formaldehyde | ||||||
| Algemeen | ||||||
| Molecuulformule (uitleg) | CH2O | |||||
| IUPAC-naam | methanal | |||||
| Andere namen | formaldehyde, formaline, formol, oxomethaan, methyleenoxide | |||||
| Molmassa | 30,02598 g/mol | |||||
| SMILES | C=O | |||||
| InChI | 1/CH2O/c1-2/h1H2 | |||||
| CAS-nummer | 50-00-0 | |||||
| EG-nummer | 200-001-8 | |||||
| PubChem | 712 | |||||
| Beschrijving | Kleurloos gas | |||||
| Waarschuwingen en veiligheidsmaatregelen | ||||||
| ||||||
| H-zinnen | H301 - H311 - H314 - H317 - H331 - H335 - H350 - H370[1] | |||||
| EUH-zinnen | geen | |||||
| P-zinnen | P260 - P280 - P301+P310 - P305+P351+P338 - P310[1] | |||||
| Carcinogeen | ja | |||||
| EG-Index-nummer | 605-001-00-5 | |||||
| VN-nummer | 2209 (oplossing in water) 1198 (gas)[2] | |||||
| MAC-waarde | 0,3 mg/m3 | |||||
| LD50 (ratten) | (oraal) 100 mg/kg | |||||
| LD50 (konijnen) | (dermaal) 220,1 mg/kg | |||||
| Fysische eigenschappen | ||||||
| Aggregatietoestand | gasvormig[2] | |||||
| Kleur | kleurloos[2] | |||||
| Dichtheid | 0,8153[2] g/cm³ | |||||
| Smeltpunt | −117[2] °C | |||||
| Kookpunt | −19[2] °C | |||||
| Vlampunt | −53 °C | |||||
| Oplosbaarheid in water | > 1000 g/l | |||||
| Goed oplosbaar in | water, ethanol, di-ethylether, benzeen | |||||
| Slecht oplosbaar in | chloroform | |||||
| Thermodynamische eigenschappen | ||||||
| ΔfH | −115,9 kJ/mol | |||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||||
| ||||||
Synthese
Formaldehyde wordt industrieel bereid door dehydrogenering van methanol met behulp van een zilver-katalysator en bij een temperatuur van 650 °C:
Daarnaast treedt hierbij ook de oxidatie van methanol op, die eveneens formaldehyde oplevert:
Een alternatief proces[3] met een andere katalysator gebruikt voornamelijk de tweede reactie.
Eigenschappen
Een oplossing van 37% formaldehyde in water wordt formaline of formol genoemd. Formaldehyde wordt ook in gepolymeriseerde vorm geleverd onder de naam paraformaldehyde, een wit fijn poeder. Deze vorm heeft het voordeel dat het een minder vluchtige verbinding is, die langer houdbaar is. Het nadeel is dat de verbinding in bepaalde omstandigheden te weinig reactief is, bijvoorbeeld als carbonylsubstraat in de Wittig-reactie of een reductieve aminering. Verder komt formaldehyde voor als trimeer, trioxaan. Dit is een vaste stof met een smeltpunt van 64 °C.
In een geconcentreerde waterige oplossing reageert formaldehyde tot mierenzuur. Deze oplossing wordt in verdunde vorm gebruikt als ontsmettingsmiddel en om biologische monsters te prepareren en bewaren. Het denatureert eiwitten en maakt ze onoplosbaar en lang houdbaar, maar ook veel harder, een proces dat aan looien verwant is. Biologische preparaten die in formaline gefixeerd zijn worden hard en moeilijk hanteerbaar.
Formaldehyde is een gas en kan ook opgeslagen worden als een makkelijker bewaarbare en bewerkbare chemische verbinding. Reactie met ammoniak levert hexamine, een cyclisch aminal dat door verhitting en behandeling met een zuur opnieuw tot formaldehyde kan worden omgezet. De reactie met natriumwaterstofsulfiet levert het overeenkomstig bisulfietadditieproduct, dat goed oplosbaar is in water. Dit kan door hydrolyse opnieuw in formaldehyde worden omgezet.
Toepassingen
Formaldehyde wordt gebruikt in onder andere spaanplaat, MDF, UF-isolatie en textiel (kleding, gordijnen en vitrages). Het kan ook gebruikt worden om polymeren te maken: samen met ureum wordt bijvoorbeeld ureumformaldehyde gevormd.
Formaldehyde wordt in cosmetica veel gebruikt als conserveermiddel, soms in de vorm van formaline, maar vaker door gebruik van zogenaamde formaldehydedonoren: stoffen die langzaam formaldehyde afgeven. Voorbeelden van formaldehydedonoren zijn bronopol, imidazolidinylureum, DMDM-hydantoïne en benzylhemiformal. In de cosmetische industrie wordt formaldehyde veel gebruikt als ontsmettingsmiddel van installaties en verpakkingen, waardoor veel soorten cosmetica kleine hoeveelheden formaldehyde bevatten, ook als het niet in de INCI-ingrediëntendeclaratie genoemd wordt.
In diverse branches wordt formaldehyde toegepast:
- reactiemiddel in productieprocessen (onder andere bij de bereiding van chemicaliën)
- leer-, textiel- en tapijtfabrieken
- papier- en houtverwerkende industrie
- medische sector
- agrarische bedrijven
- drankenindustrie
- Het wordt gebruikt voor het bleken en dieptereinigen van stenen opritten en terrassen, die niet direct aan de tuin grenzen. Hierbij wordt gebruikgemaakt van formaline, de waterige oplossing. Deze oplossing verwijdert ook mos.
Toxicologie en veiligheid
Formaldehyde is giftig. Methanol is giftig doordat deze stof door het enzym alcoholdehydrogenase in de lever omgezet wordt in formaldehyde.
Formaldehyde is bewezen carcinogeen voor de mens. Het carcinogene effect werd reeds duidelijk aangetoond in studies met dieren maar de epidemiologische studies bij de mens maakten nog geen formele conclusies mogelijk. Het IARC rangschikte formaldehyde tot 2004 in groep 2A (waarschijnlijk carcinogeen). In juni 2004 besloot een internationale werkgroep van experts om op basis van de bestaande epidemiologische studies formaldehyde in groep 1 te plaatsen, dus carcinogeen voor de mens.
Een van de waarschuwingen die op pakjes sigaretten, shag en andere tabakswaren wordt vermeld is dat tabaksrook onder andere formaldehyde bevat.
Formaldehyde kan de ogen, neus en keel irriteren. Er kan ook hoofdpijn en huidirritatie optreden. Het is zelfs mogelijk om een beroepsastma op deze stof te ontwikkelen.[5]
Bekende incidenten
Tussen 10 en 12 augustus 2016 is er 2730 kg formaldehyde weggelekt bij de DuPont-fabriek in Dordrecht. Twee maanden later, op 10 oktober 2016, volgde een nieuwe lekkage in diezelfde fabriek en heeft het provinciebestuur van Zuid-Holland diezelfde avond aangedrongen op het onmiddellijk stopzetten van twee productielijnen van de Delrin-fabriek. DuPont heeft daarop zelf besloten om deze productielijnen tot nader order stil te leggen.[6]
Zie ook
Externe links


Bronnen, noten en/of referenties
|



