Trifluorazijnzuur
Trifluorazijnzuur of TFA is het eenvoudigste stabiele gefluoreerd carbonzuur met als brutoformule C2HF3O2. De zuivere stof komt voor als een heldere kleurloze vloeistof met een prikkelende geur, die goed oplosbaar is in water. Trifluorazijnzuur wordt vaak gebruikt als reagens in de organische synthese.
Trifluorazijnzuur
| ||||
| Structuurformule en molecuulmodel | ||||
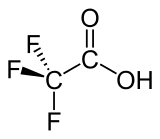 | ||||
Structuurformule van trifluorazijnzuur | ||||
 | ||||
Trifluorazijnzuur in een ampul | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C2HF3O2 | |||
| IUPAC-naam | 2,2,2-trifluorethaanzuur | |||
| Andere namen | TFA | |||
| Molmassa | 114,02335 g/mol | |||
| SMILES | FC(F)(F)C(O)=O | |||
| InChI | 1S/C2HF3O2/c3-2(4,5)1(6)7/h(H,6,7) | |||
| CAS-nummer | 76-05-1 | |||
| EG-nummer | 200-929-3 | |||
| PubChem | 6422 | |||
| Beschrijving | Heldere vloeistof met een prikkelende geur | |||
| Vergelijkbaar met | trichloorazijnzuur | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H314 - H332 - H412 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P273 - P280 - P305+P351+P338 - P310 | |||
| Hygroscopisch? | ja | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos | |||
| Dichtheid | 1,535 g/cm³ | |||
| Smeltpunt | −15 °C | |||
| Kookpunt | 72 °C | |||
| Vlampunt | −3 °C | |||
| Dampdruk | 1,07 × 103 Pa | |||
| Oplosbaarheid in water | (bij 20°C) 1520 g/l | |||
| Goed oplosbaar in | water, ethanol, aceton, di-ethylether | |||
| log(Pow) | 0,79 | |||
| Brekingsindex | 1,2855 (589 nm, 20 °C) | |||
| Evenwichtsconstante(n) | pKa = 0,23 | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Op industriële schaal wordt trifluorazijnzuur bereid door elektrofluoridering van acetylchloride of azijnzuuranhydride, gevolgd door hydrolyse van het gevormde trifluoracetylfluoride:[1]
Een oudere syntheseroute verloopt via de oxidatie van 2,2,2-trifluorethanol met kaliumpermanganaat.[2]
Het zuur kan ook bekomen worden door de hydrolyse van het overeenkomstig carbonzuuranhydride, trifluorazijnzuuranhydride.
Voorkomen in de natuur
Trifluorazijnzuur komt in zeer lage concentraties (< 200 ng/L) voor in zeewater. Het ontstaat door de foto-oxidatie van 1,1,1,2-tetrafluorethaan en 1,1,2,2-tetrafluorethaan, die als koelmiddelen worden gebruikt.
Eigenschappen en reacties
Trifluorazijnzuur is in zuivere toestand een heldere kleurloze vloeistof, die onder invloed van hitte of ultrasone trillingen kan ontleden met vorming van het giftige en corrosieve waterstoffluoride. In onzuivere toestand kan de vloeistof geel verkleuren. In contact met metalen en basen (waaronder ammoniak) treden hevige exotherme reacties op. De reactie met lithiumaluminiumhydride is zelfs explosief.
Trifluorazijnzuur is het kleinste stabiele gefluoreerd carbonzuur: fluormierenzuur zou een nog eenvoudiger perfluorcarbonzuur zijn, maar die verbinding valt spontaan uiteen in waterstoffluoride en koolstofdioxide.
In tegenstelling tot azijnzuur is trifluorazijnzuur een sterk organisch zuur als gevolg van de invloed van de sterk elektronenzuigende trifluormethylgroep. Het na deprotonering ontstane carboxylaat-anion is namelijk zeer goed gestabiliseerd. Met een pKa van 0,23 is het ongeveer 33.000 keer zuurder dan azijnzuur.
Toepassingen
Trifluorazijnzuur wordt gebruikt in de bereiding van trifluoracetylfluoride en 2,2,2-trifluorethanol.
Het zuur wordt bij sommige HPLC-analyses aan de mobiele fase toegevoegd om het optreden van tailing te verminderen. Met name bij de analyse van biochemische preparaten zoals peptiden en proteïnen is het van belang om tailing te voorkomen, omdat deze monsters vaak een zeer complexe samenstelling hebben. De toepassing als anti-tailing-reagens is gebaseerd op de ion-paarvorming die optreedt tussen trifluorazijnzuur enerzijds en peptiden en kleine proteïnen anderzijds.
In de organische chemie wordt de stof gebruikt in verband met een gunstige combinatie van eigenschappen: vluchtig, goed oplosbaar in zowel polaire als apolaire oplosmiddelen en een uitstekende zuursterkte.[3] Bovendien is het minder sterk oxiderend dan zwavelzuur en veel gemakkelijker watervrij te verkrijgen dan veel andere zuren, hetgeen voordelig is bij het gebruik van trifluorazijnzuur als niet-waterig oplosmiddel. Het enige nadeel is dat trifluorazijnzuur een azeotroop met water vormt bij 105 °C. Verder wordt het zuur vaak gebruikt als bouwsteen bij de synthese van farmaceutische stoffen en landbouwchemicaliën, en als katalysator bij polymerisaties en condensatiereacties.
Op de grens tussen organische chemie en biochemie wordt trifluorazijnzuur gebruikt tijdens de in-vitropeptidesynthese om de beschermende tert-butoxycarbonylgroep van aminogroepen te verwijderen.
Trifluorazijnzuur wordt, onder de vorm van zijn zouten (de trifluoracetaten), toegepast in de productie van keramische materialen zoals YBa2Cu3O{7-x}.[4]
Gedeutereerd trifluorazijnzuur is een veelgebruikt gedeutereerd oplosmiddel in de NMR-spectroscopie.
In de massaspectrometrie wordt trifluorazijnzuur gebruikt om de apparatuur te kalibreren.[5]
Toxicologie en veiligheid
Trifluorazijnzuur is een corrosieve stof die brandwonden kan veroorzaken. Bij contact met de ogen kan permanente beschadiging optreden en inademing van dampen (die ontstaan bij contact met lucht) kan hevige irritaties (hoesten en kortademigheid) en longoedeem teweegbrengen. Er kan tevens schade aan de slijmvliezen optreden.
Trifluorazijnzuur wordt doorgaans opgeslagen in kunststoffen recipiënten (vervaardigd uit teflon of polypropeen) in een goed-geventileerde droge opslagruimte. Het is tevens niet corrosief ten opzichte van glas of keramiek. Zeer zuiver trifluorazijnzuur wordt commercieel verhandeld in kleine glazen ampullen.
Trifluorazijnzuur is schadelijk voor in het water levende organismen vanwege de persistentie in het milieu.
Externe links
- (en) MSDS van trifluorazijnzuur
- (en) Gegevens van Trifluorazijnzuur in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
Bronnen, noten en/of referenties
|

