Kaliumpermanganaat
Kaliumpermanganaat is een anorganische verbinding van kalium en mangaan, met als brutoformule KMnO4. De stof komt voor als donkerpaarse kristallen, die goed oplosbaar zijn in water en daarbij een intens paarse oplossing produceren. Kaliumpermanganaat is een sterke oxidator en ontleedt gemakkelijk onder afgifte van zuurstof (O2) tot kaliumhydroxide (KOH) en mangaan(IV)oxide (MnO2).
Kaliumpermanganaat
| |||||
| Structuurformule en molecuulmodel | |||||
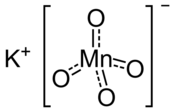 | |||||
Structuurformule van kaliumpermanganaat | |||||
 | |||||
Kaliumpermanganaat-kristallen | |||||
| Algemeen | |||||
| Molecuulformule (uitleg) | KMnO4 | ||||
| IUPAC-naam | kaliumpermanganaat | ||||
| Andere namen | kaliumtetraoxomanganaat(VII), kaliummanganaat(VII) | ||||
| Molmassa | 158,04 g/mol | ||||
| SMILES | O-[Mn](=O)(=O)=O.K+ | ||||
| InChI | 1/K.Mn.4O/q+1;;;;;-1/rK.MnO4/c;2-1(3,4)5/q+1;-1 | ||||
| CAS-nummer | 7722-64-7 | ||||
| EG-nummer | 231-760-3 | ||||
| PubChem | 516875 | ||||
| Vergelijkbaar met | Paarse kristallen | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H272 - H302 - H410 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P220 - P273 - P501 | ||||
| Opslag | Gescheiden van brandbare en reducerende stoffen en metaalpoeders. Goed gesloten. | ||||
| EG-Index-nummer | 025-002-00-9 | ||||
| VN-nummer | 1490 | ||||
| ADR-klasse | Gevarenklasse 5.1 | ||||
| MAC-waarde | 1 | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | paars | ||||
| Dichtheid | 2,703 g/cm³ | ||||
| Smeltpunt | (ontleedt) 240 °C | ||||
| Oplosbaarheid in water | 64 g/l | ||||
| Goed oplosbaar in | water | ||||
| Geometrie en kristalstructuur | |||||
| Kristalstructuur | orthorombisch | ||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Het wordt/werd wel in de geneeskunde gebruikt als ontsmettingsmiddel. In de eerste helft van de 20e eeuw was het een primitief hulpmiddel bij geboorteregeling. Na de gemeenschap werd de vagina geïrrigeerd met een verdunde oplossing van kaliumpermanganaat. Dit zou een zaaddodende werking hebben (maar ook candidose veroorzaken). Ook wordt het wel door kunstenaars en bronsgieters gebruikt om beelden te patineren in een diepbruine kleur.
De stof is opgenomen in de lijst van essentiële geneesmiddelen van de WHO.
Synthese
Kaliumpermanganaat wordt op industriële schaal bereid uit mangaan(IV)oxide en kaliumhydroxide, met zuurstofgas als oxidator. Hierbij wordt in eerste instantie kaliummanganaat gevormd, dat in een tweede stap verder wordt geoxideerd met chloorgas.
Het gevormde kaliummanganaat kan ook geoxideerd worden met koolstofdioxide:
Eigenschappen en reacties
Kaliumpermanganaat kan op verschillende manieren reageren, afhankelijk van de pH. Een belangrijke reactie in de analytische chemie is de reductie tot mangaan(II) in sterk zuur milieu (E° = 1,52 V):
Daarbij kan echter een nevenreactie optreden, waarbij de reductie stopt bij mangaan(IV)oxide (E° = 1,67 V):
Een vrij analoge reactie, maar dan in basisch milieu is de volgende (E° = 0,57):
De reductie van het permanganaat- tot het manganaat-ion in basisch milieu wordt aangewend bij het capteren van waterstofcyanide, dat in een reactie vrijkomt (E° = 0,54 V):
pH-afhankelijkheid
Hoewel waterstofionen niet gereduceerd worden, spelen ze wel een cruciale rol in het verloop van de reacties. Naarmate de pH stijgt, en dus de concentratie waterstofionen daalt, neemt het oxiderend vermogen af (behalve voor de reductie van permanganaat tot manganaat). De afname gaat voor de verschillende reacties niet even snel. Met behulp van de Nernstvergelijking en rekening houdend met de concentratie kaliumpermanganaat kunnen volgende trends afgeleid worden:
- Als kaliumpermanganaat in ondermaat aanwezig is, treedt reactie 1 op bij een pH kleiner dan 2. Bij hogere pH-waarden zal reactie 2 optreden. Ondermaat is normaal tijdens het uitvoeren van een titratie, dus is reactie 1 de werkelijke titratiereactie.
- Als permanganaat in overmaat aanwezig is treedt reactie 2 op.
- Bij pH-waarden van 6 en hoger treedt reactie 4 op.
Oplosbaarheid
De oplosbaarheid van kaliumpermanganaat is sterk afhankelijk van de temperatuur zoals uit onderstaande blijkt.[1]
| Temperatuur in °C | Oplosbaarheid in g/l |
|---|---|
| 0 | 28,3 |
| 10 | 44 |
| 20 | 64 |
| 30 | 91 |
| 40 | 125 |
| 50 | 224 |
| 75 | 324 |
Toepassingen
In de analytische chemie wordt kaliumpermanganaat gebruikt als oxiderende titrant. Een grote verscheidenheid aan oxideerbare stoffen kan kwantitatief bepaald worden met dit reagens. De reactie kan, wegens de sterke kleur van kaliumpermanganaat, gevolgd worden door de kleurverandering bij het equivalentiepunt spectrometrisch (doorgaans via UV/VIS-spectroscopie) vast te leggen. Er hoeft dus geen indicator toegevoegd te worden. Bepalingen met permanganaat hebben een paar nadelen:
- glaswerk wordt snel vies door de na het equivalentiepunt optreden reactie van permanganaat naar mangaan(IV)oxide (bruine neerslag)
- ze moeten in sterk zuur milieu (vaak met pH ongeveer 0) uitgevoerd worden
- de hoge E°-waarde maakt het reagens weinig discriminerend: wanneer organische contaminaties aanwezig zijn, worden deze ook geoxideerd en dit kan leiden tot meetfouten
- Omdat Kaliumpermanganaat een sterke oxidator is, wordt het ook gebruikt bij pyrotechnieken en wordt vaak met aluminium gecombineerd.
Toxicologie en veiligheid
Kaliumpermanganaat is een sterke oxidator en is bijgevolg schadelijk voor de huid, de ogen en de luchtwegen. De stof is ook licht corrosief voor ogen en huid, voornamelijk bij intensere en langdurige blootstelling. Contact met de ogen kan blindheid veroorzaken en contact met de huid kan roodheid, jeuk en allergische reacties oproepen.
Bronnen, noten en/of referenties
|


