Vanadiumoxytrichloride
Vanadiumoxytrichloride is een anorganische verbinding van vanadium met als brutoformule VOCl3. De stof komt voor als een gele tot bruine vloeistof, die sterk hydrolyseert in contact met waterdamp uit de lucht of water tot waterstofchloride. De stof is erg toxisch en corrosief. Vanadiumoxytrichloride is een sterke oxidator.
Vanadiumoxytrichloride
| ||||
| Structuurformule en molecuulmodel | ||||
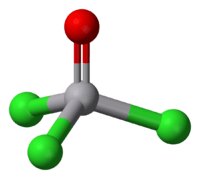 | ||||
Molecuulmodel van vanadiumoxytrichloride | ||||
 | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | VOCl3 | |||
| IUPAC-naam | vanadium(V)oxychloride | |||
| Andere namen | vanadylchloride | |||
| Molmassa | 173,30 g/mol | |||
| SMILES | VOCl3 | |||
| CAS-nummer | 7727-18-6 | |||
| EG-nummer | 231-780-2 | |||
| PubChem | 24410 | |||
| Beschrijving | Gele tot bruine vloeistof | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H301 - H314 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P280 - P301+P310 - P305+P351+P338 - P310 | |||
| VN-nummer | 2443 | |||
| ADR-klasse | Gevarenklasse 8 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | geel-bruin | |||
| Dichtheid | 1,826[1] g/cm³ | |||
| Smeltpunt | −77[1] °C | |||
| Kookpunt | 126,7[1] °C | |||
| Dampdruk | 8,1 × 102[1] Pa | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Vanadiumoxytrichloride wordt bereid door vanadium(V)oxide te chloreren, met bijmenging van actieve kool:
Koolstof fungeert als reductor. De reactietemperatuur is hoger dan het kookpunt van VOCl3, zodat de vrijkomende damp kan opgevangen worden en geadsorbeerd, maar lager dan 400 °C.[2] Bij hogere temperatuur wordt er meer vanadium(IV)chloride (VCl4) gevormd en minder vanadiumoxytrichloride. Een variant op deze methode is de reactie tussen thionylchloride en vanadium(V)oxide:
Er kan ook worden uitgegaan van vanadium(III)oxide:
Eigenschappen
Aangezien vanadiumoxytrichloride een vijfwaardige vanadiumverbinding is, is ze diamagnetisch. De molecule neemt een tetraëdrische structuur aan, waarbij de O-V-Cl-bindingshoeken telkens 111° bedragen en de Cl-V-Cl-bindingshoeken 108°. De bindingslengten van de V-O- en V-Cl-binding bedragen respectievelijk 157 en 214 picometer.
De vloeistof is oplosbaar in apolaire oplosmiddelen, zoals benzeen, tolueen, dichloormethaan en hexaan.
Reacties
Hydrolyse en alcoholyse
Vanadiumoxytrichloride reageert zeer hevig met zuiver water, waarbij corrosief waterstofchloride wordt gevormd:
Daarnaast ondergaat het met alcoholen een alcoholyse:
Reactie tot andere vanadiumverbindingen
Vanadiumoxytrichloride wordt gebruikt als precursor voor de synthese van vanadiumoxydichloride:
Reactie met dichloormonoxide leidt tot vorming van vanadiumoxidemonochloride:
Adductvorming
Vanadiumoxytrichloride is een sterk lewiszuur en vormt daarom zeer vlot adducten met verschillende basen, zoals acetonitril en amines. Deze adductvorming induceert een geometrische verandering van de molecule. Vanadiumoxytrichloride gaat over van een tetraëdrische naar een octaëdrische geometrie:
Toepassingen
Vanadiumoxytrichloride wordt gebruikt als een reagens en katalysator in de organische synthese. Het is een co-katalysator voor de productie van ethyleen-propyleenrubbers (EPDM), meestal samen met een organische aluminiumverbinding (zoals ethylaluminiumsesquichloride).[3]
Externe links
Bronnen, noten en/of referenties
|

