Thionylchloride
Thionylchloride (of thionyldichloride) is een anorganische stof met formule SOCl2. SOCl2 is een reactieve chemische stof die gebruikt wordt in chloreringsreacties. Chemisch gezien is thionylchloride het dizuurchloride van zwaveligzuur. Het is een kleurloze tot gele vloeistof bij kamertemperatuur die degradeert boven 140 °C. SOCl2 wordt soms verward met sulfurylchloride, SO2Cl2, maar de chemische eigenschappen van deze S(IV)- en S(VI)-stoffen zijn zeer verschillend.
Thionylchloride
| |||||
| Structuurformule en molecuulmodel | |||||
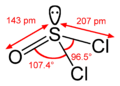 | |||||
Structuurformule van thionylchloride | |||||
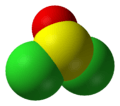 | |||||
Molecuulmodel van thionylchloride | |||||
| Algemeen | |||||
| Molecuulformule (uitleg) | SOCl2 | ||||
| Molmassa | 118,97 g/mol | ||||
| CAS-nummer | 7719-09-7 | ||||
| EG-nummer | 231-748-8 | ||||
| Beschrijving | Gele vloeistof | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H302 - H314 - H318 - H330 - H331 - H332 - H335[1] | ||||
| EUH-zinnen | EUH014 - EUH029 | ||||
| P-zinnen | P261 - P264 - P270 - P271 - P280 - P284 - P301+P312 - P301+P330+P331 - P303+P361+P353 - P304+P340 - P305+P351+P338 - P310 - P311 - P312 - P320 - P321 - P330 - P363 - P403+P233 - P405 - P501[1] | ||||
| Hygroscopisch? | reageert met water | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vloeibaar | ||||
| Kleur | geel | ||||
| Dichtheid | 1,638 g/cm³ | ||||
| Smeltpunt | −104,5 °C | ||||
| Kookpunt | 75,3 °C | ||||
| Viscositeit | 0,06 Pa·s | ||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Eigenschappen en structuur
Thionylchloride is piramidaal qua structuur, wat aangeeft dat er een vrij elektronenpaar op het zwavelcentrum zit. Het vergelijkbare molecuul COCl2 (fosgeen) is vlak.
Thionylchloride reageert met water om zo waterstofchloride en zwaveldioxide te vormen.
- H2O + O=SCl2 → SO2 + 2 HCl
Vanwege de hoge reactiviteit met water wordt thionylchloride niet aangetroffen in de natuur.
Industrieel gebruik
Thionylchloride wordt gebruikt in lithium-thionylchloride-batterijen als het positieve materiaal, met lithium als het negatieve materiaal. Het wordt ook gebruikt als reagens in de productie van diverse chemische stoffen.
Thionylchloride wordt gebruikt als grondstof voor zenuwgassen uit de G-serie (Tabun, Sarin en Soman).
Gebruik in organische chemie
Thionylchloride wordt veel gebruikt om carbonzuren[2][3] en alcoholen[4][5] om te zetten in de bijbehorende acylchloriden en alkylchloriden respectievelijk. Het wordt verkozen boven andere reagentia zoals fosforpentachloride omdat de producten van de thionylchloridereacties, HCl en SO2, gassen zijn, wat het zuiveren van het product vereenvoudigt. Een overmaat aan thionylchloride kan verwijderd worden door middel van destillatie.
Sulfonzuren reageren met thionylchloride om zo sulfonylchlorides te produceren.[6][7]
Diverse reacties
Thionylchloride reageert met primaire formamides om zo isocyaniden te vormen.[8]
Amiden reageren met thionylchloride om zo imidoylchloriden te vormen. Primaire amiden reageren onder verhitting door met thionylchloride om nitrilen te vormen.[9]
Synthese van thionylchloride
De grootschalige industriële synthese is de reactie van zwaveltrioxide met zwaveldichloride:[10]
Andere methoden zijn:
- SO2 + PCl5 → SOCl2 + POCl3
- SO2 + Cl2 + SCl2 → 2 SOCl2
- SO3 + Cl2 + 2 SCl2 → 3 SOCl2
De eerste van de drie bovenstaande reacties levert ook fosforoxychloride op, wat in vele reacties op thionylchloride lijkt.
Zie ook
Bronnen, noten en/of referenties
|


