Coördinatieverbinding
Coördinatieverbindingen of (metaal)complexen zijn chemische verbindingen die bestaan uit één of meer (transitie of overgangs-)metalen[1] en één of meer liganden. In de techniek is het verschijnsel ook bekend onder de naam chelatie. Een ligand is een neutraal molecuul of een ion dat een vrij elektronenpaar heeft (negatief ion), dat gebruikt kan worden om een binding te vormen met een metaalion. Een coördinatieverbinding is neutraal (coördinatieverbinding) of geladen (complex ion). In het laatste geval heeft het een positief of negatief tegenion bij zich. Een opvallende eigenschap van coördinatieverbindingen is dat ze meestal een karakteristieke kleur aannemen, alsook bijzondere magnetische en spectroscopische eigenschappen vertonen.
sulfaat.png)
Basisconcepten
De binding tussen een metaalion en een ligand is een covalente binding met een partieel ionair karakter, waarbij het bindend elektronenpaar afkomstig is van het ligand alleen (een zogenaamde elektronenpaardonor). Daarom wordt de binding ook wel een donor-acceptorbinding, coördinatief-covalente binding of datieve binding genoemd.
Een voorbeeld: de verbinding [CoCl(NH3)5]Br2 bestaat uit een kobaltion met 5 (ongeladen) NH3-moleculen en een negatief geladen chloride-ion aan zich gebonden. Dit geheel heeft een lading van 2+, dus zijn er 2 bromide-ionen aanwezig als tegenionen.
Nomenclatuur
Coördinatieverbinding bezitten een eigen nomenclatuur, die gebaseerd is op volgende regels:
- Het kation wordt eerst genoemd, vervolgens het anion
- Bij een complex ion worden de namen van de liganden eerst genoemd (zie tabel hieronder), voor de naam van het metaalion
- Anionische liganden krijgen een uitgang -o (fluor wordt dus fluoro).
- Neutrale liganden krijgen hun gewone moleculaire benaming (met uitzondering van water, ammoniak, koolstofmonoxide en stikstofmonoxide)
- Het aantal monodentate liganden wordt met de klassieke Griekse prefixen (di-, tri-, tetra-, penta-, ...) beschreven. Voor polydentate liganden en liganden die reeds een Grieks prefix dragen (bijvoorbeeld ethyleendiammine), wordt een alternatief prefix gebruikt: bis-, tris-, tetrakis-, pentakis-, ...
- De oxidatietoestand van het centraal metaalion wordt aangeduid met een Romeins cijfer
- Als er meer dan 1 soort ligand voorkomt, worden deze alfabetisch gerangschikt. Voor deze alfabetische rangschikking hoeft met de namen van de prefixen geen rekening te worden gehouden.
- Wanneer het complex ion een negatieve lading draagt, wordt aan de naam van het centraal metaalion de uitgang -aat toegevoegd. De stam is de Latijnse naam van het metaal.
Namen van liganden
| Ligand | Formule (bindend atoom is dikgedrukt) | Meestvoorkomende denticiteit |
|---|---|---|
| jodido | I− | monodentaat |
| bromido | Br− | monodentaat |
| chlorido | Cl− | monodentaat |
| fluorido | F− | monodentaat |
| thio | S2− | monodentaat (M=S) bidentaat (M-S-M') |
| thiocyanato | S-CN− | monodentaat |
| isothiocyanato | N=C=S− | monodentaat |
| nitrosyl | NO | monodentaat |
| nitro | N-O2− | monodentaat |
| nitrito | ONO− | monodentaat |
| nitrato | O-NO2− | monodentaat |
| azido | N-N2− | monodentaat |
| cyano | CN− | monodentaat |
| cyanato | OCN− | monodentaat |
| isocyanato | NCO− | monodentaat |
| hydroxo | O-H− | monodentaat |
| aqua | H-O-H | monodentaat |
| ammine | NH3 | monodentaat |
| carbonyl | CO | monodentaat |
| pyridino | C5H5N | monodentaat |
| acetonitrilo | CH3CN | monodentaat |
| oxalato | [O-C(=O)-C(=O)-O]2− | bidentaat |
| ethyleendiamine | NH2-CH=CH-NH2 (afgekort tot en) | bidentaat |
| 2,2'-bipyridine | NC5H4-C5H4N (afgekort tot bipy) | bidentaat |
| glycinato | NH2-CH2C(=O)-OH | bidentaat |
| di-ethyleentriamine | NH2-C2H3-NH-C2H3-NH2 | tridentaat |
| terpyridine | NC5H4-NC5H3-NC5H4 | tridentaat |
| 1,4,7-triazacyclononaan | C6H12(NH)3 | tridentaat |
| ftalocyanine | (NC8H4N)2-(NC8H5N)2 | tetradentaat |
| porfyrine | tetradentaat | |
| tri-ethyleentetramine | NH2-C2H3-NH-C2H3-NH-C2H3-NH2 | tetradentaat |
| tris(2-amino-ethyl)amine | N(CH2CH2NH2)3 | tetradentaat |
| ethyleendiaminetriacetaat | pentadentaat | |
| 2.2.2-cryptand | N[CH2CH2-OCH2CH2O-CH2CH2]3N | hexadentaat |
| ethyleendiaminetetra-azijnzuur (EDTA) | (CH2C(=O)O)2-N-CH2-CH2-N-(CH2C(=O)O)2 | hexadentaat |
Namen van metaalionen in complexe anionen
| Metaal | Symbool | Naam in het complex anion |
|---|---|---|
| aluminium | Al | aluminaat |
| titanium | Ti | titanaat |
| vanadium | V | vanadaat |
| chroom | Cr | chromaat |
| mangaan | Mn | manganaat |
| ijzer | Fe | ferraat |
| kobalt | Co | cobaltaat |
| nikkel | Ni | nikkelaat |
| koper | Cu | cupraat |
| zink | Zn | zinkaat |
| niobium | Nb | niobaat |
| molybdeen | Mo | molybdaat |
| technetium | Tc | technetaat |
| ruthenium | Ru | ruthenaat |
| palladium | Pd | palladaat |
| zilver | Ag | argentaat |
| cadmium | Cd | cadmiaat |
| tin | Sn | stannaat |
| hafnium | Hf | hafniaat |
| tantalium | Ta | tantalaat |
| wolfraam | W | wolframaat |
| renium | Re | renaat |
| iridium | Ir | iridaat |
| platina | Pt | platinaat |
| goud | Au | auraat |
| kwik | Hg | mercuraat |
| lood | Pb | plumbaat |
Voorbeelden
| Formule | Naam van het complex |
|---|---|
| K4Fe(CN)6 | kaliumhexacyanoferraat(II) Geel bloedloogzout |
| K3Fe(CN)6 | kaliumhexacyanoferraat(III) Rood bloedloogzout |
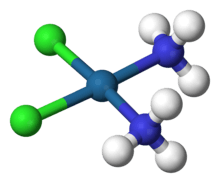
| [Co(NH3)5Cl]Cl2 | penta-amminechlorokobalt(III)chloride |
| [Fe(en)2(NO2)2]SO4 | bis(ethyleendiamine)dinitroijzer(III)sulfaat |
| [Ru(NH3)5Cl]S | penta-amminechlororuthenium(II)sulfide |
| Na2[Au(CN)3F2] | natriumtricyanodifluoroauraat(III) |
| [Pt(CO)3H2O]Br2 | aquatricarbonylplatina(II)bromide |
| [Nb(NH3)4(NO2)2]NO2 | tetra-amminedinitroniobium(III)nitriet |
Liganden
De liganden binden aan het centrale metaalion via de donatie van een vrij elektronenpaar. Het coördinatiegetal van een complex geeft weer hoeveel donoratomen er aan het metaalion gebonden zijn in de eerste coördinatiesfeer. Hierbij moet men rekening houden met de verschillende soorten liganden:
- Liganden met 1 donoratoom: deze liganden kunnen slechts 1 elektronenpaar doneren aan het metaalion en worden daarom monodentate liganden genoemd. Voorbeelden in deze context zijn ammoniak, water en koolstofmonoxide.
- Liganden met meer dan 1 donoratoom (deze worden polydentate liganden of chelaten genoemd):
- 2 donoratomen (bidentaat ligand), zoals bijvoorbeeld ethyleendiamine, oxalaat, aminoacetaat en acetylaceton
- 3 donoratomen (tridentaat ligand), zoals di-ethyleentriamine
- 4 donoratomen (tetradentaat ligand):
- Open-keten-ligand: 1,3,7,9-tetra-aza-undecaan
- Gesloten-keten-ligand (macrocyclisch ligand): 1,4,8,11-tetraminecyclotetradecaan
- Meer dan 4 donoratomen: zoals bijvoorbeeld EDTA (hexadentaat)
Coördinatiegetal toekennen
Het coördinatiegetal wordt aan een complex ion of een coördinatieverbinding toegekend op basis van het aantal donoratomen dat zich rond het centraal metaalion heeft geplaatst.
- Voorbeeld 1 - [Pt(NH3)6]4+
Hierbij zit een platina(IV+)ion gecoördineerd met 6 ammine-liganden. Elk ammine-ligand bezit op stikstof een vrij elektronenpaar, dat gebruikt wordt voor de coördinatief covalente verbinding. Aangezien er 6 van dergelijke liganden zijn, betekent dit dat het coördinatiegetal 6 bedraagt.
- Voorbeeld 2 - [Co(NH3)2(en)2]2+
Hierbij zit een kobalt(II+)ion gecoördineerd met 2 ammine-liganden en 2 ethyleendiamine-liganden. Elk ammine-ligand bezit een vrij elektronenpaar op stikstof; elk ethyleendiammine heeft 2 stikstoffen met elk een vrij elektronenpaar en bezit dus 2 donoratomen. Dat betekent dat deze verbinding als coördinatiegetal 6 draagt.
- Voorbeeld 3 - [Hg(CN)3(CO)2]−
Hierbij zit een kwik(II+)ion gecoördineerd met 3 cyano-liganden en 2 carbonyl-liganden. Elk cyano-ligand heeft een vrij elektronenpaar op stikstof; elk carbonyl-ligand bezit een vrij elektronenpaar op koolstof. Dat betekent dat het coördinatiegetal van dit complex 5 is.
Zuur gedrag van metaalionen in water
De metaal-ligand-binding kan worden beschreven als de interactie tussen een lewisbase en een lewiszuur. Hierbij neemt het metaalion de rol van het lewiszuur over en de liganden die van de lewisbase. In een waterige oplossing zijn alle ionen gehydrateerd. Een voorbeeld vormt [Fe(H2O)6]3+ of kortweg Fe3+(aq). Veel gehydrateerde ionen (dit zijn zogenaamde aqua-complexen) reageren in een oplossing als een zwak zuur:
- [Fe(H2O)6]3+ + H2O → [Fe(H2O)5(OH)]2+ + H3O+
De zuursterkte van het gehydrateerde metaalion is afhankelijk van de sterkte van de binding tussen het centraal metaalion en het zuurstofatoom van de gebonden watermolecule. Als deze binding zeer sterk is, dan wordt de O-H-binding in water verzwakt en kan een H+-ion worden afgesplitst. Als deze binding echter zwak is, dan wordt een volledige watermolecule afgesplitst. De sterkte van de binding tussen het metaalion en het zuurstofatoom in water is afhankelijk van 2 belangrijke factoren:
- Op basis van de elektrostatische aantrekkingskracht tussen het kation en de water-dipool (wet van Coulomb) kan men concluderen dat kleine ionen met een hoge lading (bijvoorbeeld Fe3+) het sterkst zuur zullen reageren.
- Als het kation (centraal metaalion) een lewiszuur is dat over vacante atoomorbitalen beschikt (transitiemetalen uit periode 4, 5 en 6), heeft de binding tussen het metaalion en het zuurstofatoom een covalent karakter. De binding wordt dus versterkt en het zuur karakter verhoogt.
Geometrische structuur
Afhankelijk van het aantal liganden en de lading kan een complex verschillende geometrische vormen aannemen, meestal een waarbij de liganden en vrije elektronen zo ver mogelijk van elkaar zitten. Onderstaande tabel geeft een overzicht van de verschillende geometrische structuren van een complexverbinding.
| Coördinatiegetal | Geometrie | Hybridisatie van het metaalion | Voorbeeld |
|---|---|---|---|
| 2 | lineair | sp | [Ag(NH3)2]+ |
| 3 | trigonaal planair | sp2 | [PdCl3]− |
| 4 | tetraëdrisch | sp3 | [Zn(CN)4]2− |
| 4 | vierkant planair (tetragonaal) | dsp2 | [Ni(CN)4]2− |
| 5 | vierkant piramidaal | d2sp2 | [VOCl4]2− |
| 5 | trigonaal bipiramidaal | dsp3 | Fe(CO)5 |
| 6 | octaëdrisch | d2sp3 | [Co(NH3)6]3+ |
| 7 | pentagonaal bipiramidaal | d3sp3 | |
| 8 | vierhoekig antiprisma | d4sp3 | [Mo(CN)8]4− |
| 9 | drievoudig afgeknot trigonaal prisma | d5sp3 | [ReH9]2− |
Sommige metaalionen kunnen nog meer liganden coördineren. De oorzaak hiervan ligt in de relatieve grootte van de liganden en de positieve lading op het metaalion. Zo werd in 2007 melding gemaakt van een opmerkelijk stabiel lood-complex dat door niet minder dan 15 heliumliganden werd omringd: PbHe152+.
Isomerie
Coördinatieverbindingen bezitten, in het geval van meerdere soorten liganden, veelal isomeren. Er kunnen ruwweg 2 soorten isomeren bij coördinatieverbindingen onderscheiden worden:
Structuurisomerie
Het algemeen principe bij structuurisomeren van coördinatieverbindingen is het feit dat er telkens andere liganden aan het centraal metaalion zijn gebonden. Er wordt onderscheid gemaakt tussen volgende structuurisomerren:
- [Co(NH3)5SO4]Br (rood complex) → [Co(NH3)5SO4]+ + Br−
- [Co(NH3)5Br]SO4 (paars-violet complex) → [Co(NH3)5Br]2+ + SO42−
- Coördinatie-isomeren: deze isomeren bezitten 2 of meerdere metaalionen, die fungeren als coördinatiecentrum. De liganden kunnen op die manier telkens op een ander metaalion binden.
- Hydraat-isomeren: dit zijn ionisatie-isomeren met als ligand H2O
- Linkage-isomeren: dit zijn isomeren die een ligand bezitten dat op verschillende manieren (met telkens andere donoratomen) kan gebonden zijn aan het metaalion. Voorbeeld:
- [Co(NH3)5(NO2)]Cl2: hierbij bindt het vetgedrukte ligand via stikstof (nitro-verbinding)
- [Co(NH3)5(ONO)]Cl2: hierbij bindt het vetgedrukte ligand via zuurstof (nitrito-verbinding)
Stereo-isomerie
Bij stereo-isomeren zal het complex het aantal liganden behouden, maar zullen deze telkens op een andere plaats gerangschikt zijn rondom het centraal metaalion. Er wordt onderscheid gemaakt tussen 2 soorten stereo-isomeren:
- Cis- en trans-isomeren
- Optische isomeren (enantiomeren)
Cis- en trans-isomerie
Cis- en trans-isomerie kan in complexe verbindingen optreden bij een octaëdrische of tetragonaal planaire structuur. Wanneer 2 dezelfde liganden naast elkaar liggen, staan ze cis ten opzichte van elkaar. Als ze tegenover elkaar staan, dan staan ze trans ten opzichte van elkaar. Wanneer 3 dezelfde liganden een zijde van een octaëder bepalen, dan staan deze fac (afgeleid van faciaal) ten opzichte van elkaar. Hierbij zullen minstens 2 liganden cis staan. Als 3 liganden en het centraal metaalion in 1 vlak liggen, dan liggen zij mer (afgeleid van meridionaal) ten opzichte van elkaar. Onderstaande structuren geven een voorbeeld (de groene chloor-liganden dienen als toonbeeld):
.png) cis-[CoCl2(NH3)4]+
cis-[CoCl2(NH3)4]+.png) trans-[CoCl2(NH3)4]+
trans-[CoCl2(NH3)4]+.png) fac-[CoCl3(NH3)3
fac-[CoCl3(NH3)3.png) mer-[CoCl3(NH3)3
mer-[CoCl3(NH3)3
Optische isomerie
Optische isomeren van complexe verbindingen komen voor bij chirale of disymmetrische moleculen. Ze ontstaan door het spiegelbeeld van een molecule te vormen en zijn dus niet superponeerbaar (de atomen kunnen op geen enkele manier samenvallen met elkaar). Dit heeft te maken met het feit dat ze optisch actief zijn: ze zorgen voor een rotatie van het vlak van gepolariseerd licht. De twee optische isomeren worden ook wel enantiomeren of enantiomorfen genoemd.
Het symbool lambda (Λ) duidt op een enantiomeer dat een linksdraaiende conformatie bezit (de zogenaamde laevo-vorm). Het symbool delta (Δ) duidt op een enantiomeer dat rechtsdraaiende conformatie bezit (de zogenaamde dextro-vorm). Hieronder staat voor het trisoxalatoferraat(III)ion een voorbeeld van elk:
ferrate(III)-3D-balls.png) Δ-[Fe(ox)3]3−
Δ-[Fe(ox)3]3−ferrate(III)-3D-balls.png) Λ-[Fe(ox)3]3−
Λ-[Fe(ox)3]3−
Complexen in de biochemie
Voorbeelden van complexen in de biochemie zijn hemoglobine, dat een ijzer-atoom bevat en bladgroen (chlorofyl), dat magnesium bevat (beiden met een porfine-ring als ligand).
Andere voorbeelden van coördinatieverbindingen worden gevonden met name gevonden in de katalyse, maar ook in geneesmiddelen, kleurstoffen en enzymen.
Zie ook
- Carbonylcomplex
- Coördinatiechemie
- Chelatie
- Cyclopentadienylcomplex
- Kristalveldtheorie
- Ligandveldtheorie
- Spectrochemische reeks
Bronnen, noten en/of referenties
|
| Zie de categorie Complex ions van Wikimedia Commons voor mediabestanden over dit onderwerp. |