Lewisbase
Een Lewisbase is volgens de zuur-basetheorie van Gilbert Lewis een deeltje (een molecule of een ion) dat over vrije elektronen beschikt die gebruikt kunnen worden om een chemische binding met een Lewis-zuur te vormen. Een Lewisbase is dus in feite een elektronenpaardonor.
| ZUREN en BASEN |
|---|
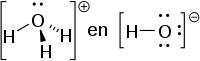 |
| Algemene begrippen |
| pH Zuur-basereactie Zuur-basetitratie Zuurconstante Buffer Waterevenwicht Hammett-zuurfunctie |
| Zuren |
|
Sterk · Zwak · Lewiszuur · Anorganisch zuur · Organisch zuur · Superzuur · Oxozuur · Halogeenzuurstofzuur |
| Basen |
|
Sterk · Zwak · Lewisbase · Organische base |
| Portaal |
Beide elektronen die voor de vorming van de binding nodig zijn, worden door de Lewisbase geleverd. De resulterende binding wordt dan ook een donor-acceptor-binding genoemd.
Elk deeltje dat een vrij elektronenpaar in de valentieschil bezit kan als Lewisbase fungeren. Een nucleofiel is dus een Lewisbase. In een complex fungeren de liganden als Lewisbasen. Koolstofmonoxide kan bijvoorbeeld als ligand fungeren, want het bezit zowel op het zuurstofatoom als op het koolstofatoom een vrij elektronenpaar.
Het begrip Lewisbase is een uitbreiding van het begrip base volgens Brønsted.