Tetraëdrische moleculaire geometrie
In de scheikunde verwijst een tetraëdrische moleculaire geometrie naar moleculen waarbij een centraal atoom omringd wordt door 4 atomen, die elk op de hoekpunten van een denkbeeldige tetraëder zijn gelegen. De bindingshoeken bedragen ongeveer 109,5° wanneer de 4 atomen gelijk zijn. Een klassiek voorbeeld hiervan is methaan. De perfecte tetraëdrische moleculen behoren tot puntgroep Td.
Tetraëdrische moleculaire geometrie
| ||||
| Ruimtelijke structuur | ||||
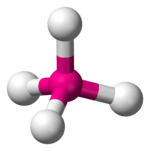 | ||||
| Eigenschappen | ||||
| Puntgroep | Td | |||
| Bindende elektronenparen | 4 | |||
| Vrije elektronenparen | 0 | |||
| Bindingshoeken | 109,5° | |||
| Coördinatiegetal | 4 | |||
| AXE-symbool | AX4E0 | |||
| ||||
Naast verzadigde organische verbindingen komen ook de meeste verbindingen van silicium, germanium en tin voor als tetraëders. Andere voorbeelden van tetraëdrische verbindingen zijn xenontetraoxide, osmium(VIII)oxide en de ionen perchloraat, tetrahydroboraat(III), sulfaat en fosfaat. Bij transitiemetalen en hun complexen komen tetraëders voornamelijk voor bij elektronenconfiguraties d0 of d10. Voorbeelden zijn tetrakis(trifenylfosfine)palladium(0), nikkeltetracarbonyl en titanium(IV)chloride.