Coördinatiegetal
Het coördinatiegetal (Engels: coordination number) is in de scheikunde het aantal bindingen dat een bepaald atoom maakt met andere atomen (of ionen). Met andere woorden is het een geheel getal dat aangeeft met hoeveel andere atomen een atoom verbonden is. In een kristal is het coördinatiegetal het aantal dichtstbijzijnde atomen. Een kristalstructuur kan door de coördinatiegetallen van alle atomen in haar eenheidscel beschreven worden.
Coördinatiegetal bij chemische verbindingen
Het coördinatiegetal van een chemische verbinding werd voor het eerst gedefinieerd door Alfred Werner in 1893. Dit getal is het totale aantal buren dat een atoom in een molecuul of ion heeft.[1] Een koolstofatoom heeft in de meeste moleculen vier bindingen, maar het coördinatiegetal van koolstof is vier in methaan (CH4), drie in ethyleen (H2C=CH2, elke koolstofatoom heeft bindingen met twee waterstof- en een ander koolstofatoom) en twee in acetyleen.
Voor het coördinatiegetal doet alleen de eerste binding (de sigma-binding) met een buuratoom ertoe, verdere bindingen (pi-bindingen) worden niet geteld. In de anorganische chemie wordt ook alleen de eerste (sigma-) binding geteld met elke ligand, maar geen pibindingen met dezelfde ligands. In wolfraamhexacarbonyl (W(CO)6) bijvoorbeeld is het coördinatiegetal van wolfraam zes, hoewel zowel sigma- als pi-bindingen in dit type metaal-carbonylverbindingen belangrijk zijn.
Voorbeelden van hoge coördinatiegetallen zijn complexen waarin uranium en thorium voorkomen met bidentaat-nitraatliganden: U(NO3)62− en Th(NO3)62−. Elke nitraatligand is in deze verbindingen gebonden met het kation door twee zuurstofatomen, zodat het coördinatiegetal van het metaal in beide gevallen twaalf is. Als de omringende liganden kleiner worden, zijn zelfs hogere coördinatiegetallen mogelijk. Computationele berekeningen laten zien dat een stabiel complex met een centraal lood-kation omringd door vijftien heliumatomen mogelijk is (PbHe152+).[2] Een complex met coördinatiegetal 15 is in 2009 daadwerkelijk gevormd: het thorium-aminodiboranaat [Th(H3BNMe2BH3)4]. Het centraal thoriumatoom heeft bindingen met vijftien waterstofatomen. Dit was mogelijk door een zeer groot metaalatoom te combineren met zeer kleine liganden. Volgens de auteurs is een complex met coördinatiegetal 16 ook mogelijk mits de correcte combinatie van metaal en liganden.[3]
Coördinatiegetal bij kristallen

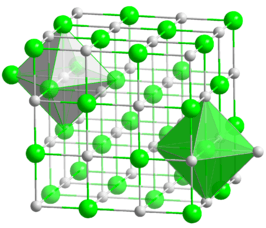
Omdat de bindingen van atomen in kristallen ingewikkeld zijn, wordt het coördinatiegetal bij kristallen niet bepaald door het aantal bindingen van een atoom, maar door het aantal andere atomen waartoe de afstand minimaal is. In de kristallografie worden atomen in een kristalrooster vereenvoudigd tot bollen met een straal die zo groot mogelijk is zonder andere bollen te snijden. Dit model vereenvoudigt een kristalrooster tot een stapeling van bollen die elkaar raken. Het coördinatiegetal van een atoom is het aantal andere bollen dat het raakt. De meest voorkomende coördinatiegetallen zijn vier en zes, maar ook twee, drie, acht en twaalf kunnen voorkomen. Bij complexen zijn nog andere getallen mogelijk.
Hoe dichter de kristalstructuur, hoe hoger de coördinatiegetallen van de atomen doorgaans zijn. Koolstof heeft bijvoorbeeld in grafiet een coördinatiegetal van drie, in diamant een coördinatiegetal van 4. In kristallen met een kubisch ruimtelijk gecentreerd (bcc) kristalrooster, zoals het metaal ijzer, hebben alle atomen een coördinatiegetal van acht. Het hoogst mogelijke coördinatiegetal, twaalf, wordt aangetroffen in kristallen met een hexagonaal ruimtelijk gecentreerd (hcc) kristalrooster. Twaalf is het hoogst mogelijke getal, dit wordt wel het kusgetal (kissing number) genoemd.
Bij bepaalde kristalstructuren kan dezelfde structuureenheid (een ion, atoom, complex of molecuul) echter op meerdere verschillende posities voorkomen, waarbij het coördinatiegetal per positie verschilt.
Notatie
Coördinatiegetallen kunnen in de kristallografie op verschillende manieren worden genoteerd. Eén manier is tussen rechte haken, dan wordt bijvoorbeeld natriumchloride als volgt genoteerd: Na[6] Cl[6]. Dit betekent dat elk natrium-kation aan 6 chloride-anionen raakt en elk chloride-anion aan 6 natrium-kationen. Deze specifieke coördinatie betekent dat het kristalrooster rechte hoeken heeft en dat bij beide ion-soorten de coördinatiepolyeder een octaëder is.
Een andere manier is tussen ronde haken achter de chemische formule. Voor calciumfluoride is deze vorm van notatie bijvoorbeeld: CaF2 (8, 4). Elk calcium-kation is in deze structuur omgeven door acht fluoride-anionen en elk fluoride-anion door vier calcium-kationen.
De coördinatiegetallen worden ook gebruikt in nigglinotaties. Dit zijn notaties waarmee de structuur van een kristal beschreven kan worden.
Bronnen
Voetnoten
Literatuur
|