Trifluormethaansulfonzuur
Trifluormethaansulfonzuur (afgekort tot TfOH of HOTf) is een sulfonzuur met als brutoformule CF3SO3H. Zouten en esters worden triflaten genoemd. Het is een van de sterkste bekende zuren en wordt daarom gerekend tot de zogenaamde superzuren.[1] Het zuur, alsook zouten en esters ervan, worden veel gebruikt in chemische reacties, als katalysator (onder meer bij Friedel-Craftsacyleringen) of als bron voor de triflaatgroep, die een uitstekende leaving group is.
Trifluormethaansulfonzuur
| ||||
| Structuurformule en molecuulmodel | ||||
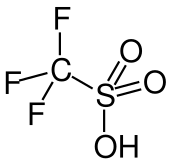 | ||||
Structuurformule van trifluormethaansulfonzuur | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | CF3SO3H | |||
| Molmassa | 150,08 g/mol | |||
| CAS-nummer | 1493-13-6 | |||
| EG-nummer | 216-087-5 | |||
| Beschrijving | Kleurloze vloeistof met prikkelende geur | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H290 - H302 - H314 - H335 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P280 - P305+P351+P338 - P310 | |||
| Hygroscopisch? | ja | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos | |||
| Dichtheid | (bij 20°C) 1,708 g/cm³ | |||
| Smeltpunt | −40 °C | |||
| Kookpunt | 161-162 °C | |||
| Dampdruk | (bij 20°C) 890 Pa | |||
| Matig oplosbaar in | water | |||
| Evenwichtsconstante(n) | pKa = ± −15 | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Trifluormethaansulfonzuur werd voor het eerst gesynthetiseerd in 1954 door Haszeldine en Kidd uitgaande van koolstofdisulfide, joodpentafluoride, trifluorjoodmethaan en zwavel, via onderstaande methode:[2]
 Synthese van trifluormethaansulfonzuur
Synthese van trifluormethaansulfonzuur
Een andere methode is de elektrochemische fluorering (ECF) van methaansulfonylfluoride:
 Synthese van trifluormethaansulfonzuur
Synthese van trifluormethaansulfonzuur
De oxidatie van methyltrifluormethylsulfide met kaliumpermanganaat of waterstofperoxide levert ook trifluormethaansulfonzuur:
 Synthese van trifluormethaansulfonzuur
Synthese van trifluormethaansulfonzuur
De industriële bereiding maakt gebruik van de hydrolyse van methaansulfonylfluoride, gevolgd door aanzuren van het reactiemengsel. Trifluormethaansulfonzuur wordt ten slotte opgezuiverd door destillatie.
Eigenschappen
Trifluormethaansulfonzuur is bij kamertemperatuur een hygroscopische kleurloze vloeistof met een indringende en prikkelende geur. Het is goed oplosbaar in polaire oplosmiddelen zoals dimethylformamide (DMF), dimethylsulfoxide (DMSO), acetonitril en dimethylsulfon. Tijdens het toevoegen van het zuur aan polaire oplosmiddelen kan een gevaarlijk exotherme reactie optreden.
Met een pKa van ongeveer −15 voldoet trifluormethaansulfonzuur ruim aan de kwalificatie van superzuur. Het dankt een groot deel van zijn bruikbaarheid aan zijn grote thermische en chemische stabiliteit. Zowel het zuur als zijn geconjugeerde base, triflaat, zijn bestand tegen oxidatie en reductie. Dit in tegenstelling tot veel andere superzuren zoals waterstofperchloraat (HClO4) en salpeterzuur (HNO3), die naast sterke zuren ook sterke oxidatoren zijn. Het triflaat-anion is bestand tegen de sterkste nucleofielen.
In vochtige lucht vormt trifluormethaansulfonzuur een witte nevel (vergelijkbaar met zoutzuur of de combinatie van zoutzuur en ammoniak), waarbij het stabiele, vaste monohydraat gevormd wordt. Deze stof heeft een smeltpunt van 34 °C.
Toepassingen
Trifluormethaansulfonzuur wordt vooral vanwege zijn zuursterkte toegepast.
Zoutvorming
Trifluormethaansulfonzuur reageert exotherm met carbonaten en hydroxiden, waarbij de overeenkomstige triflaat-zouten gevormd worden. Een voorbeeld is de reactie met koper(II)carbonaat:
In synthetisch opzicht is de reactie tussen chloorcomplexen van overgangsmetalen en trifluormethaansulfonzuur interessant:
Deze omzetting vindt plaats in zuiver trifluormethaansulfonzuur bij 100 °C, waarna het gevormde zout neerslaat bij toevoeging van di-ethylether.
Organische reacties
Met acylhalogeniden vormt trifluormethaansulfonzuur gemengde anhydriden, die als zeer sterke acylerende reagentia gebruikt worden. Een voorbeeld is de reactie met acetylchloride:
Met het gevormde reagens kan bijvoorbeeld benzeen vlot geacyleerd worden:
Trifluormethaansulfonzuur katalyseert de reactie van aromatische verbindingen met sulfonylchloriden, mogelijk met gemengde anhydriden als intermediair.
Externe links
- (en) MSDS van trifluormethaansulfonzuur
- (en) Gegevens van Trifluormethaansulfonzuur in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
Bronnen, noten en/of referenties
|