Gebogen moleculaire geometrie
In de scheikunde verwijst een gebogen moleculaire geometrie naar moleculen waarbij drie atomen via twee bindingen verbonden zijn met elkaar en waarbij deze twee bindingen een hoek kleiner dan 180° vormen. Een voorbeeldverbinding is water, waarbij de twee O-H-bindingen een hoek van 104,45° vormen. Andere voorbeelden zijn stikstofdioxide, waterstofselenide en zwaveldichloride. Het centrale element van deze verbindingen bevat steeds 2 vrije elektronenparen.
Gebogen moleculaire geometrie
| ||||
| Ruimtelijke structuur | ||||
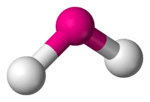 | ||||
Ruimtelijke schikking van de atomen | ||||
 | ||||
Ruimtelijke schikking van de atomen en het vrij elektronenpaar (geknikt) | ||||
 | ||||
Ruimtelijke schikking van de atomen en de vrije elektronenparen (gebogen) | ||||
| Eigenschappen | ||||
| Puntgroep | C2v | |||
| Bindende elektronenparen | 2 | |||
| Vrije elektronenparen | 1 of 2 | |||
| Bindingshoeken | 120° of 109,5° | |||
| Coördinatiegetal | 2 | |||
| AXE-symbool | (geknikt) AX2E1 (gebogen) AX2E2 | |||
| ||||
In het geval dat het centrale element slechts 1 vrij elektronenpaar draagt, wordt soms van een geknikte structuur gesproken, omdat de bindingshoek groter is (120°). Een voorbeeld hiervan is zwaveldioxide.
This article is issued from
Wikipedia.
The text is licensed under Creative
Commons - Attribution - Sharealike.
Additional terms may apply for the media files.