Sulfaat
Sulfaat is in de anorganische chemie de zuurrest van zwavelzuur en de zouten ervan.
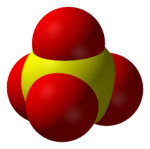

Structuur en eigenschappen
Het sulfaation is een polyatomisch oxoanion van zwavel met als brutoformule SO en een molaire massa van 96,06 g/mol. Het ion bestaat uit een centraal zwavelatoom omgeven door vier zuurstofatomen in een tetraëdrische geometrie. Het sulfaation bezit een tweewaardig negatieve lading. Het is de geconjugeerde base van het waterstofsulfaation (ook bekend onder de verouderde namen hydrosulfaat en bisulfaat), met als formule HSO4−, dat op zijn beurt weer een geconjugeerde base is van zwavelzuur (H2SO4).
Sulfaatverbindingen ontstaan wanneer kationen combineren met het anion SO42−-ion. Meestal resulteert deze combinatie in een zout, hoewel sulfaat ook een covalente binding kan aangaan met de meeste niet-metalen. Een sulfaatester is bijvoorbeeld een covalente verbinding van een sulfaatgroep met een organische restgroep. Een voorbeeld hiervan is dimethylsulfaat. Dergelijke verbindingen worden bereid door de reactie van zwavelzuur met een geschikt alcohol, zoals bijvoorbeeld methanol:
Toepassingen
Sulfaten zijn belangrijk in zowel de chemische industrie als in biologische systemen:
- De loodaccu gebruikt zwavelzuur (H2SO4).
- Sommige anaerobe micro-organismen, zoals die in de diepzee vlak bij thermische bronnen, gebruiken sulfaten in hun metabolisme.
- Kopersulfaat (CuSO4) is een standaard algenverdelger of (in watervrije toestand) als indicator voor water.
- Magnesiumsulfaat (MgSO4) wordt gebruikt in therapeutische baden.
- Gips, het natuurlijke mineraal uit gehydrateerd calciumsulfaat (CaSO4 · 2 H2O), wordt gebruikt voor het maken van pleister.
- Het sulfaation wordt gebruikt als tegenion voor sommige kationische geneesmiddelen.
Oxoanionen van zwavel
Naast sulfaat bestaan ook nog andere oxoanionen van zwavel:
- persulfaat: SO
- sulfiet: SO
- hyposulfiet: SO
- peroxodisulfaat: S2O
Voorbeelden van sulfaten
- Aluin
- Bariumsulfaat
- Calciumsulfaat (gips)
- IJzer(II)sulfaat
- IJzer(III)sulfaat
- Koper(II)sulfaat
- Natriumsulfaat (Glauberzout)
- Natriumdodecylsulfaat
- Natriumwaterstofsulfaat
- Zwavelzuur
| Zoek sulfaat op in het WikiWoordenboek. |
| Zie de categorie Sulfates van Wikimedia Commons voor mediabestanden over dit onderwerp. |