Cyclisch adenosinemonofosfaat
Cyclisch adenosinemonofosfaat of cAMP (ook aangeduid als cyclisch AMP of 3'-5'-cyclisch adenosinemonofosfaat) is een cyclisch nucleotide die een belangrijke rol speelt in verscheidene biochemische processen in de cel. De structuur is afgeleid van adenosinemonofosfaat (AMP) en is eveneens verwant met die van adenosinetrifosfaat (ATP), het belangrijkste energiedragende molecuul dat voorkomt in organismen. cAMP is een zogenaamde secundaire boodschapper, die wordt gebruikt voor intracellulaire signaaltransductie. Zo geeft het de effecten door van hormonen als glucagon en adrenaline, die zich niet door het celmembraan kunnen verplaatsen. De belangrijkste functie van cAMP is de activering van eiwitkinases. cAMP reguleert voorts de doorgifte van Ca2+ door ionkanalen.
Cyclisch adenosinemonofosfaat
| ||||
| Structuurformule en molecuulmodel | ||||
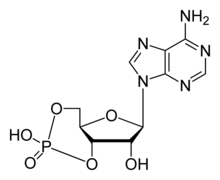 | ||||
Structuurformule van cyclisch adenosinemonofosfaat | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C10H12N5O6P | |||
| Molmassa | 329,205941 g/mol | |||
| SMILES | C1C2C(C(C(O2)N3C=NC4=C3N=CN=C4N)O)OP(=O)(O1)O | |||
| InChI | 1S/C10H12N5O6P/c11-8-5-9(13-2-12-8)15(3-14-5)10-6(16)7-4(20-10)1-19-22(17,18)21-7/h2-4,6-7,10,16H,1H2,(H,17,18)(H2,11,12,13)/t4-,6-,7-,10-/m1/s1 | |||
| CAS-nummer | 60-92-4 | |||
| EG-nummer | 200-492-9 | |||
| PubChem | 6076 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Smeltpunt | (ontleed) 260 °C | |||
| Oplosbaarheid in water | 0,010 g/l | |||
| Slecht oplosbaar in | water | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
In zuivere toestand is het een wit kristallijn poeder, dat slecht oplosbaar is in water. Het overeenkomstige natriumzout is ongeveer 20 keer beter oplosbaar.
Earl Sutherland van de Vanderbilt University won in 1971 de Nobelprijs voor de Fysiologie of Geneeskunde "voor de ontdekking van de activiteit van hormonen, in het bijzonder adrenaline, via secundaire signaalmoleculen (zoals cAMP)."
Synthese en afbraak van cAMP
Cyclisch adenosinemonofosfaat wordt door adenylaatcyclase gesynthetiseerd uit ATP. Adenylaatcyclase bevindt zich aan de intracellulaire zijde van het celmembraan en wordt geactiveerd door de hormonen glucagon en adrenaline, en door G-eiwitten. Adenylaatcyclase uit de lever reageert sterker op glucagon, en adenylaatcyclase uit spiercellen reageert sterker op adrenaline.
Afbraak van cAMP tot AMP wordt gekatalyseerd door het enzym fosfodiësterase. Dit enzym wordt geïnhibiteerd door hoge concentraties cafeïne. Mogelijk is het stimulerende effect van deze drug het gevolg van de verhoging van het cAMP-niveau dat door cafeïne wordt veroorzaakt. Een meer waarschijnlijke verklaring is echter dat het effect van cafeïne iets te maken heeft met het adenosinedeel van cAMP.
Biochemische functies
Activering van eiwitkinase
cAMP is betrokken bij sommige eiwitkinases. Zo is bijvoorbeeld PKA (eiwitkinase A, ook wel cAMP-afhankelijke eiwitkinase genoemd) gewoonlijk een inactief tetrameer holo-enzym, opgebouwd uit 2 katalytische en 2 regulatie-eenheden. Deze laatste blokkeren de katalysecentra van de katalytische eenheden. Na binding van cAMP dissociëren de verschillende eenheden, zodat de katalyse-eenheden substraateiwitten kunnen fosforyleren. Fosforylering is een enzymatische reactie waarbij een fosfaatgroep aan een eiwit wordt gekoppeld, dat vervolgens resulteert in veranderingen in de functionele eigenschappen van dat eiwit.
Cyclisch adenosinemonofosfaat en eiwitkinase A spelen een belangrijke rol bij het functioneren van cellen. Hun rol in de regulatie van genexpressie is reeds veelvuldig bestudeerd. In levercellen zijn deze moleculen ook onontbeerlijk voor het suikermetabolisme, het in goede banen leiden van het intracellulaire vervoer van eiwitten en vetten, de vorming van functionele galkanaaltjes en de uitscheiding van gal.
Regulatie van glycogeenafbraak
cAMP bestuurt veel biologische processen, waaronder de afbraak van glycogeen tot glucose (de zogenaamde glycogenolyse), en lipolyse.
Rol in Dictyostelium discoideum
Het cyclisch adenosinemonofosfaat wordt door de slijmzwam Dictyostelium discoideum afgescheiden wanneer voedsel in de omgeving schaars begint te worden. De cAMP-moleculen zullen door diffusie andere slijmzwamcellen bereiken, binden daar op specifieke receptoren en induceren hierdoor de vorming van een multicellulaire, slakachtige kolonie.
Rol van cAMP in bacteriën
In bacteriën is het cAMP-niveau afhankelijk van het groeimedium. Wanneer glucose dient als koolstofbron, is er weinig cAMP aanwezig, doordat adenylaatcyclase wordt geïnhibeerd bij glucosetransport de cel in. De transcriptiefactor CRP (of CAP) vormt een complex met cAMP en wordt daardoor geactiveerd om DNA te binden. Dit CRP-cAMP-complex bevordert de expressie van een groot aantal genen, waaronder sommige die coderen voor enzymen die onafhankelijk van glucose energie kunnen leveren.
| Nucleotiden | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|