Berylliumoxide
Berylliumoxide is het oxide van beryllium, met als brutoformule BeO. De stof komt voor als zeer toxische witte reukloze kristallen. In de natuur komt het voor als het mineraal bromelliet. Voorheen werd de verbinding ook wel aangeduid met de naam glucina (van het Griekse glykys, wat zoet betekent), verwijzend naar de zoete smaak van beryllium en diens verbindingen. Desalniettemin zijn deze verbindingen bijzonder giftig. Bij het inhaleren van minieme hoeveelheden stofdeeltjes van berylliumoxide kan zich bij de mens na verloop van tijd de dodelijke longziekte berylliose ontwikkelen.
Berylliumoxide
| ||||
| Structuurformule en molecuulmodel | ||||
 | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | BeO | |||
| IUPAC-naam | berylliumoxide | |||
| Andere namen | beryllia | |||
| Molmassa | 25,011582 g/mol | |||
| SMILES | [Be]=O | |||
| InChI | 1S/Be.O | |||
| CAS-nummer | 1304-56-9 | |||
| EG-nummer | 215-133-1 | |||
| PubChem | 14775 | |||
| Beschrijving | Witte kristallen | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H301 - H315 - H317 - H319 - H330 - H335 - H350 - H372 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P201 - P260 - P280 - P284 - P301+P310 - P305+P351+P338 | |||
| LD50 (ratten) | (oraal) 0,5 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | 3,02 g/cm³ | |||
| Smeltpunt | 2507 °C | |||
| Kookpunt | 3900 °C | |||
| Goed oplosbaar in | geconcentreerd zwavelzuur | |||
| Onoplosbaar in | water | |||
| Brekingsindex | 1,7 (589 nm, 20 °C) | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | hexagonaal | |||
| Thermodynamische eigenschappen | ||||
| ΔfH | −609,4 kJ/mol | |||
| S | 13,77 J/mol·K | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Berylliumoxide wordt bereid door oxidatie van beryllium met zuurstofgas:
Het kan ook bereid worden uit thermolyse van berylliumcarbonaat, berylliumoxalaat of berylliumnitraat:
Een alternatieve manier is de dehydratie van berylliumhydroxide:
Eigenschappen en binding
Berylliumoxide is - in tegenstelling tot andere aardalkalimetaaloxiden - eerder amfoteer dan basisch, wat impliceert dat het zowel met zuren als met basen kan reageren.
Het kan niet gereduceerd worden met natrium, kalium, magnesium, aluminium of waterstofgas. Het kan wel gereduceerd worden met koolstof en bij hoge temperatuur (carbothermische reductie).[1]
In de gasfase is berylliumoxide aanwezig als afzonderlijke diatomische moleculen. De binding tussen zuurstof en beryllium is covalent van aard. De elektronische structuur van het monomeer is eerder uitzonderlijk: de overlap van orbitalen laat enkel één sterke covalente binding toe, terwijl de overige 2 orbitalen een te zwakke overlap bieden om een covalente dan wel ionaire binding te vormen. Het resultaat is een diradicalaire molecule in de triplet-toestand, hetgeen meestal wordt voorgesteld als een dubbele binding. Deze voorstelling is echter in wezen foutief.
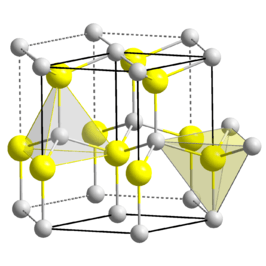
Kristalstructuur
Berylliumoxide neemt een hexagonale kristalstructuur aan, de zogenaamde wurtziet-structuur.[2] Dit in tegenstelling tot de overige aardalkalimetaaloxiden, die uitkristalliseren in een kubisch kristalstelsel. Bij hogere temperatuur wordt de hexagonale structuur omgezet in een tetragonale.
Toepassingen
Gesinterd berylliumoxide is zeer stabiel en bezit keramische eigenschappen. Het wordt verwerkt in halfgeleiders, die gebruikt worden in radioapparatuur. De reden hiervoor is dat berylliumoxide een hoge thermische geleidbaarheid (330 W/m·K) bezit en tegelijkertijd ook een zeer goede elektrische isolator is.[2]
Externe links
Bronnen, noten en/of referenties
|

