Vinylacetaat
Vinylacetaat is een organische verbinding met als brutoformule C4H6O2. Het is een kleurloze, licht ontvlambare vloeistof met een zoete geur, die slecht oplosbaar is in water.
Vinylacetaat
| ||||
| Structuurformule en molecuulmodel | ||||
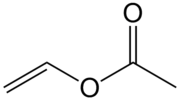 | ||||
Structuurformule van vinylacetaat | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C4H6O2 | |||
| IUPAC-naam | ethenylethanoaat | |||
| Andere namen | VAM (vinyl acetate monomer), 1-acetoxyetheen | |||
| Molmassa | 86,08924 g/mol | |||
| SMILES | C=COC(C)=O | |||
| CAS-nummer | 108-05-4 | |||
| EG-nummer | 203-545-4 | |||
| PubChem | 7904 | |||
| Beschrijving | Kleurloze vloeistof met kenmerkende geur | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H225 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P210 | |||
| VN-nummer | 1301 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos | |||
| Dichtheid | 0,934 g/cm³ | |||
| Smeltpunt | −110,2 °C | |||
| Kookpunt | 72,7 °C | |||
| Vlampunt | −8 °C | |||
| Zelfontbrandings- temperatuur | 426,9 °C | |||
| Dampdruk | 11.700 Pa | |||
| Oplosbaarheid in water | 20 g/l | |||
| Goed oplosbaar in | ethanol, ethylacetaat | |||
| Slecht oplosbaar in | water | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Vinylacetaat kan formeel opgevat worden als de ester van vinylalcohol en azijnzuur. Echter, een verestering tussen deze componenten kan in de praktijk nooit uitgevoerd worden, aangezien vinylalcohol het onstabiele tautomeer van aceetaldehyde is.
Synthese
De synthese van vinylacetaat kan langs verschillende wegen gebeuren. De oudste productiemethode (uitgevonden door Fritz Klatte in 1912) betreft de reactie van ethyn met azijnzuur, al dan niet in aanwezigheid van een katalysator. Veruit de meest gebruikte industriële methode is de reactie van etheen met azijnzuur en zuurstofgas, in de aanwezigheid van een gepaste katalysator (palladium of een palladiumverbinding op een poreuze drager, zoals actieve kool of calciumcarbonaat):
Als nevenreactie van deze synthesemethode treedt de oxidatie van etheen tot koolstofdioxide en water op:
Toepassingen en reacties
Polymerisatie
Vinylacetaat is een belangrijk industrieel tussenproduct, vooral voor polymeren. Het wordt in de eerste plaats gebruikt als monomeer voor polyvinylacetaat en polyvinylalcohol; daarnaast ook samen met andere monomeren voor copolymeren zoals ethyleen-vinylacetaat (EVA), ethyleen-vinylalcohol en polyvinylbutyral (PVB). Circa 80% van het geproduceerde vinylacetaat gaat naar de productie van polyvinylacetaat en polyvinylalcohol. De wereldwijde productiecapaciteit van vinylacetaat in het jaar 2000 bedroeg ongeveer 4,7 miljoen ton.
Vinylacetaat polymeriseert onder invloed van licht. De productie van polyvinylacetaat langs deze weg werd in 1913 in Duitsland gepatenteerd door Fritz Klatte (Duits octrooi nr. 281687 van 4 juli 1913). De opslag van vinylacetaat dient bijgevolg te gebeuren weg van het licht en gestabiliseerd met een geschikte inhibitor (Fritz Klatte vond zelf dat opslag in koperen vaten of in aanwezigheid van een koperverbinding polymerisatie verhinderde). Tegenwoordig wordt vinylacetaat commercieel verhandeld met 3 tot 20 ppm hydrochinon als polymerisatie-inhibitor.
Overige reacties
Vinylacetaat ondergaat talrijke reacties die typisch zijn voor zowel alkenen als esters. Zo levert de additie van dibroom het vicinaal dibromide. Waterstofhalogeniden, zoals waterstofchloride of waterstofbromide, leveren door additie aan de dubbele binding de overeenkomstige 1-halogeenethylacetaten. Deze kunnen via geen enkele andere methode bereid worden, omdat het overeenkomstig gehalogeneerd alcohol niet bestendig is. In aanwezigheid van palladium als katalysator addeert azijnzuur met vorming van ethylideendiacetaat. De dubbele binding kan ook deelnemen aan diels-alderreacties en [2+2]-cycloaddities.
Vinylacetaat ondergaat transesterificaties met een groot aantal carbonzuren.
Externe links
- (en) MSDS van vinylacetaat
- (en) Gegevens van Vinylacetaat in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
